【答案】
分析:①固体粉末于一个烧杯中,加入足量NaOH稀溶液,有气体产生,证明一定含有金属铝,过滤得到固体A和无色溶液B,溶液B为NaAlO
2溶液;
②将①中所得固体A洗涤后分成两份.一份加入CuSO
4溶液,无明显变化,证明一定无金属铁,另一份加入足量稀硫酸,过滤得到固体C和棕黄色溶液D.推断固体C为碳粉,棕黄色溶液D为硫酸铁溶液,证明一定含有氧化铁或四氧化三铁;
综上所述:混合粉末中 一定含有铝、碳、铁的氧化物;一定不含铁;依据推断出的物质分析回答;
解答:解:某难溶于水的混合粉末中除含有炭粉外,还可能含有铁、铝的单质和它们的某一种氧化物.
①固体粉末于一个烧杯中,加入足量NaOH稀溶液,有气体产生,证明一定含有金属铝,过滤得到固体A和无色溶液B,溶液B为NaAlO
2溶液;
②将①中所得固体A洗涤后分成两份.一份加入CuSO
4溶液,无明显变化,证明一定无金属铁,另一份加入足量稀硫酸,过滤得到固体C和棕黄色溶液D.推断固体C为碳粉,棕黄色溶液D为硫酸铁溶液,证明一定含有氧化铁或四氧化三铁;推断为:混合粉末中一定含有铝、碳、铁的氧化物;一定不含铁;
(1)①反应的离子方程式是铝和氢氧化钠溶液的反应,离子方程式为:2Al+2OH
-+2H
2O=2AlO
2-+3H
2↑,
故答案为:2Al+2OH
-+2H
2O=2AlO
2-+3H
2↑;
(2)依据推断固体C为碳粉,与浓硫酸受热后发生反应的化学方程式为:C+2H
2SO
4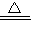
CO
2↑+2SO
2↑+2H
2O,
故答案为:C+2H
2SO
4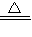
CO
2↑+2SO
2↑+2H
2O;
(3)由上述实验可以获得结论,混合物粉末中一定含有碳和铝,铁的氧化物可以是氧化铁或四氧化三铁,若要确定含铁元素的物质,还需进行一步实验,该实验方法为:取少量酸性高锰酸钾溶液于试管中,加入少量棕黄色溶液D,若紫红色溶液褪色,则说明原混合物含有Fe
3O
4;若紫红色溶液不褪色,则说明原混合物含有Fe
2O
3,
故答案为:Al;Fe
2O
3、Fe
3O
4;取少量酸性高锰酸钾溶液于试管中,加入少量棕黄色溶液D,若紫红色溶液褪色,则说明原混合物含有Fe
3O
4;若紫红色溶液不褪色,则说明原混合物含有Fe
2O
3.
点评:本题考查了物质推断、物质检验与实验方案设计等,涉及化学方程式、离子方程式的书写,题目难度中等,掌握元素化合物的性质是关键,对学生的推理有一定的要求.

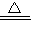 CO2↑+2SO2↑+2H2O,
CO2↑+2SO2↑+2H2O,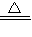 CO2↑+2SO2↑+2H2O;
CO2↑+2SO2↑+2H2O;
