
【题目】下列分散质粒子直径在10-9~10-7m的分散系是
A. 稀盐酸 B. 硫酸铜溶液 C. 酒精溶液 D. 氢氧化铁胶体
科目:高中化学 来源: 题型:
【题目】现有①氟氯烃 ②二氧化碳 ③二氧化硫 ④废弃塑料制品 ⑤富含氮、磷元素的污水。请你根据已有的环保知识,选择恰当的序号填空:
(1)能形成酸雨的是_______; (2)能破坏臭氧层的是_________;
(3)使水体富营养化的是________;(4)导致“白色污染”的是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】信息:已知在由Na2S、Na2SO3、Na2SO4三种物质组成的混合物中,钠元素的质量分数为46%,则氧元素的质量分数的计算方法为: Na2S、Na2SO3、Na2SO4有共同的部分Na2S,可拆变合一为(Na2S)Ox,则硫元素的质量分数为
2Na﹣﹣﹣ | S |
46% | 32% |
则氧元素的质量分数为1﹣46%﹣32%=22%
由NaHS、MgSO4、NaHSO3组成的混合物中,硫元素的质量分数为32%,计算该混合物中氧元素的质量分数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】既可以用来鉴别乙炔和甲烷,又可用来除去甲烷中混有的乙炔的试剂或方法是
A. 溴水 B. 酸性高锰酸钾溶液
C. 在导管口处点燃 D. —定条件下与H2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用质量分数98%、密度为1.84gcm﹣3的浓硫酸配制480mL0.92molL﹣1的稀硫酸
(1)配制时,除量筒、烧杯、玻璃棒外还需玻璃仪器有、 .
(2)减小误差量取时需选用合适的量筒量取mL浓硫酸
(3)在容量瓶的使用方法中,下列操作不正确的是 .
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线1~2cm处,改用胶头滴管加蒸馏水到标线
D.往容量瓶中转移溶液时应用玻璃棒引流
(4)在配制过程中,其他操作都是正确的,下列操作会引起误差偏高的是 . ①转移溶液时不慎有少量洒到容量瓶外面
②没有洗涤烧杯和玻璃棒
③定容时俯视刻度线
④容量瓶不干燥,含有少量蒸馏水
⑤定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线.
⑥未冷却到室温就将溶液转移到容量瓶并定容.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将淀粉浆和淀粉酶的混合物放入半透膜袋中,扎好后浸入流动的温水中,经过足够长的时间,取出袋内的液体,分别与①碘水 ②新制Cu(OH)2加热 ③浓硝酸(微热)作用,其现象依次是
A. 显蓝色;无砖红色沉淀;显黄色 B. 不显蓝色;无砖红色沉淀;显黄色
C. 显蓝色;有砖红色沉淀;不显黄色 D. 不显蓝色;有砖红色沉淀;不显黄色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铈是地壳中含量最高的稀土元素,二氧化铈(CeO2)是其重要的化合物。平板液晶显示屏生产过程中产生大量的废玻璃粉末,其中含CeO2、SiO2、Fe2O3等物质,某实验小组以此粉末为原料回收铈,设计流程如图所示:
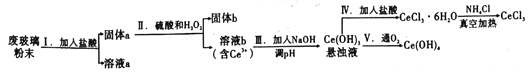
(1)步骤Ⅰ加入过量盐酸后,溶液a中的阳有离子___________________。
(2)步骤Ⅱ中反应的氧化剂和还原剂的物质的量之为___________。
(3)为了使步骤Ⅲ所得悬浊液中的Ce3+浓度为1×10-6mol·L-1,则加入NaOH调节溶液的pH应为____________[已知:Ce(OH)3的Ksp=8.0×10-21,lg2=0.3]。
(4)将NH4Cl固体与CeCl3·6H2O混合真空加热可得无水CeCl3,其中加入NH4Cl的作用是__________。
(5)第Ⅴ步反应的化学方程式是____________________;用反应得到的悬浊液制备纯净的Ce(OH)4需进行的实验操作为______________。
(6)对CeCl3样品纯度进行测定的方法:准确称取样品wg配成100mL溶液,取25.00mL置于锥形瓶中,加入稍过量的过二硫酸铵[(NH4)2S2O8]溶液将Ce3+氧化为Ce4+,然后用萃取剂[用(HT2)表示]萃取Ce4+,再用cmol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点(其离子反应方程式为Ce4++Fe2+=Ce3++Fe3+),重复2~3次,平均消耗VmL标准溶液。
①“萃取”时存在反应:Ce4++n(HT)2![]() Ce(H2n-4)+4H+,若要提高滴定的准确率,应使溶液呈______性(填“酸”“中”或“碱”)。
Ce(H2n-4)+4H+,若要提高滴定的准确率,应使溶液呈______性(填“酸”“中”或“碱”)。
②经计算,CeCl3样品的纯度为________________。 [M(CeCl3)=246.5g·mol-1]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com