
(14分)中和热的测定实验的关键是要比较准确地配制一定的物质的量浓度的溶液,在实验过程中要尽量避免热量的散失,要求比较准确地测量出反应前后溶液温度的变化。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)在大小烧杯之间填满碎泡沫(或纸条)其作用是____________________;大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”)
(3)做一次完整的中和热实验,温度计需要使用______ 次;
(4)该实验常用0.50 mol·L-1 HCl和0.55 mol·L-1的NaOH溶液各50 mL。若上述HCl、NaOH溶液的密度都近似为1 g/cm3,中和后生成的溶液的比热容C = 4.18 J/(g·℃),反应后温度升高了△t, 则生成1mol水时的反应热ΔH=___________kJ/mol(填表达式)。
(5)如果用50mL0.50mol/L醋酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),简述理由 。
(1) 环形玻璃搅拌棒 (2)保温、隔热;偏小 (3)3 ;
(4)-0.418△t/0.025 (5)不相等;因为醋酸电离需要吸收热量。
解析:(1)在测定中和热的实验中为了使溶液混合均有,在实验过程中需要搅拌,根据装置图可知还缺少环形玻璃搅拌器。
(2)为了减少热量的损失需要在大小烧杯之间填满碎泡沫以起到保温和隔热的作用。如果没有盖硬质板,会造成人类的损失,导致测定结果偏小。
(3)盐酸和氢氧化钠溶液的温度都需要测量,反应后还需要测量混合液的温度,所以至少使用3次。
(4)50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液的质量之和是100g,所以反应过程中放出的热量是100g×4.18J/(g•℃)×△t℃=0.418△tkJ。因为50mL0.50mol/L盐酸与50mL0.55mol/L
NaOH溶液反应生成水是0.025mol,所以△H=-0.418△t/0.025kJ/mol。
(5)因为醋酸是弱酸没在溶液中存在电离平衡,而电离是吸热的,所以放出的热量要少。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2012-2013学年安徽省铜陵一中高二10月月考化学试卷(带解析) 题型:实验题
(12分)中和热的测定实验的关键是要比较准确地配制一定的物质的量浓度的溶液,量热器要尽量做到绝热;在量热的过程中要尽量避免热量的散失,要求比较准确地测量出反应前后溶液温度的变化。回答下列问题:
(1)中学化学实验中的中和热的测定所需的玻璃仪器有:_________ ___________,在大小烧杯之间填满碎泡沫(或纸条)其作用是_____ _______________。
(2)该实验可用0.60 mol·L-1 HCl和0.65 mol·L-1的NaOH溶液各50 mL。NaOH的浓度大于HCl的浓度作用是___ __。当室温低于10℃时进行,对实验结果会造成较大的误差其原因是_________。
(3)若上述HCl、NaOH溶液的密度都近似为1 g/cm3,中和后生成的溶液的比热容C=4.18 J/(g·℃),则该中和反应放出热量为_____________kJ(填表达式),ΔH="___________" kJ/mol(填表达式)。
查看答案和解析>>
科目:高中化学 来源:2014届安徽省高二10月月考化学试卷(解析版) 题型:实验题
(12分)中和热的测定实验的关键是要比较准确地配制一定的物质的量浓度的溶液,量热器要尽量做到绝热;在量热的过程中要尽量避免热量的散失,要求比较准确地测量出反应前后溶液温度的变化。回答下列问题:
(1)中学化学实验中的中和热的测定所需的玻璃仪器有:_________ ___________,在大小烧杯之间填满碎泡沫(或纸条)其作用是_____ _______________。
(2)该实验可用0.60 mol·L-1 HCl和0.65 mol·L-1的NaOH溶液各50 mL。NaOH的浓度大于HCl的浓度作用是___ __。当室温低于10℃时进行,对实验结果会造成较大的误差其原因是_________。
(3)若上述HCl、NaOH溶液的密度都近似为1 g/cm3,中和后生成的溶液的比热容C=4.18 J/(g·℃),则该中和反应放出热量为_____________kJ(填表达式),ΔH=___________ kJ/mol(填表达式)。
查看答案和解析>>
科目:高中化学 来源:2014届吉林省高一下学期期初考试化学试卷(解析版) 题型:实验题
(14分)中和热的测定实验的关键是要比较准确地配制一定的物质的量浓度的溶液,在实验过程中要尽量避免热量的散失,要求比较准确地测量出反应前后溶液温度的变化。回答下列问题:
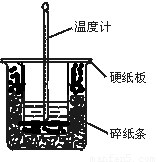
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)在大小烧杯之间填满碎泡沫(或纸条)其作用是____________________;大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”)
(3)做一次完整的中和热实验,温度计需要使用______ 次;
(4)该实验常用0.50 mol·L-1 HCl和0.55 mol·L-1的NaOH溶液各50 mL。若上述HCl、NaOH溶液的密度都近似为1 g/cm3,中和后生成的溶液的比热容C = 4.18 J/(g·℃),反应后温度升高了△t, 则生成1mol水时的反应热ΔH=___________ kJ/mol(填表达式)。
(5)如果用50mL0.50mol/L醋酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),简述理由 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com