
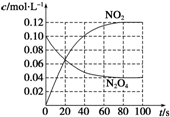
 在100℃时,将0.40mol的二氧化氮气体充入2L抽真空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
在100℃时,将0.40mol的二氧化氮气体充入2L抽真空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
| ||
|
| 0.08mol |
| 2L |
| 0.24mol |
| 2L |
| c(N2O4) |
| c(NO2) |
| 0.04mol/L |
| 0.12mol/L×0.12mol/L |
| 0.2mol |
| 2L |
 ,故答案为:0.1mol/L;
,故答案为:0.1mol/L; ;
;| 0.012mol |
| 0.2mol |


科目:高中化学 来源: 题型:
| A、71gCl2与足量的铝充分反应,转移的电子数为NA |
| B、2.3g金属钠与O2反应生成Na2O2时失去的电子数为0.2NA |
| C、标准状态下,11.2L的CCl4所含的分子数为0.5NA |
| D、1.8gNH4+所含的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、把稀硫酸滴在铁片上:2Fe+6H+=2Fe2++3H2↑ |
| B、碳酸钙与稀盐酸反应:CO32++2H+=H2O+CO2↑ |
| C、混合碳酸氢钠溶液跟盐酸:HC03-+H+=H2CO3 |
| D、金属钠投入到水中:2Na+2H2O=2Na++20H-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.8 NA |
| B、0.6 NA |
| C、0.5 NA |
| D、0.4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、有大量的氯气泄漏时,用肥皂水浸湿软布蒙面,并迅速离开现场 |
| B、金属钠着火燃烧时,用泡沫灭火器灭火 |
| C、少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗 |
| D、因为碘易溶于酒精,所以常用酒精萃取碘水中的碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com