
实验室用浓盐酸与
MnO2反应制备Cl2,再用Cl2与Ca(OH)2反应制取少量漂白粉.已知Cl2与Ca(OH)2反应制取漂白粉的反应是放热反应,温度稍高会发生副反应:6Cl2+6Ca(OH)2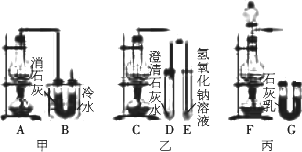
请从以下六个方面对上述甲、乙、丙三套装置的优缺点进行评价,将适当的选项序号填于下表.
a.反应不易控制
b.反应容易控制
c.有副反应发生
d.可防止副反应发生
e.容易污染环境
f.可防止污染环境
![]()
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
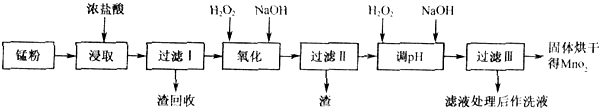
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)2 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
查看答案和解析>>
科目:高中化学 来源:2012年人教版高中化学选修1 4.3垃圾资源化练习卷(解析版) 题型:填空题
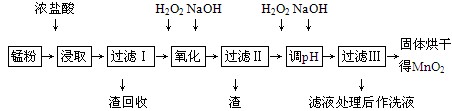
回收的废旧锌锰干电池经过处理后得到锰粉(含MnO2、Mn(OH)2、Fe、乙炔和黑炭等),由锰粉制取MnO2的步骤如下图所示。
生成氢氧化物沉淀的pH
|
物质 |
开始沉淀 |
沉淀完全 |
|
Fe(OH)3 |
2.7 |
3.7 |
|
Fe(OH)2 |
7.6 |
9.6 |
|
Mn(OH)2 |
8.3 |
9.8 |
根据上图所示步骤并参考表格数据,回答下列问题。
(1)在加热条件下用浓盐酸浸取锰粉,所得溶液中含有Mn2+、Fe2+等。MnO2与浓盐酸反应的离子方程式为___________________________________________
(2)锰粉经浓盐酸浸取,过滤Ⅰ除去不溶杂质后,向滤液中加入足量H2O2溶液,其作用是____________________________________________________________。
(3)过滤Ⅰ所得滤液经氧化后,需加入NaOH溶液调节pH约为5.1,其目的是___________________________________________________________。
(4)过滤Ⅱ所得滤液加入足量H2O2溶液并加入NaOH溶液调节pH约为9,使Mn2+氧化得到MnO2,反应的离子方程式为_____________________________________________。
(5)实验室进行过滤操作时,需要用到的玻璃仪器有________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com