
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置. 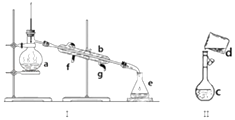
(1)写出下列仪器的名称:a.b.c. .
(2)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是 , 将仪器补充完整后进行实验,温度计水银球的位置在处.冷凝水由(填f或g)口通入.
(3)现需配制0.1mol/L CuSO4溶液450mL,装置II是某同学转移溶液的示意图.
①图中的错误是 . 除图中给出的仪器和分析天平外,为完成实验还需的仪器有: .
②根据计算得知,需称取的胆矾的质量为g.
③在100mL某浓度的CuSO4溶液中加入一质量为45.0g的铁棒,反应一段时间后,取出洗净,干燥后称量,称得质量变为46.6g.若反应后溶液的体积不变,所得溶液中FeSO4的物质的量浓度为mol/L.
【答案】
(1)蒸馏烧瓶;冷凝器(直形冷凝管);容量瓶
(2)酒精灯;蒸馏烧瓶支管口;g
(3)没有用玻璃棒引流;玻璃棒和胶头滴管;12.5;2
【解析】解:(1)由图可知仪器的名称为a.蒸馏烧瓶、b.冷凝器(直形冷凝管)、c.容量瓶,所以答案是:蒸馏烧瓶;冷凝器(直形冷凝管);容量瓶;(2)分离四氯化碳和酒精的混合物,选择蒸馏装置,需要酒精灯加热,则图中缺少仪器为酒精灯,温度计水银球的位置在蒸馏烧瓶支管口处.冷凝水由g口通入,所以答案是:酒精灯;蒸馏烧瓶支管口;g;(3)①图中的错误是没有用玻璃棒引流;除图中给出的仪器和分析天平外,为完成实验还需的仪器有玻璃棒和胶头滴管,
所以答案是:没有用玻璃棒引流;玻璃棒和胶头滴管;
②选择500mL容量瓶,需称取的胆矾的质量为0.5L×0.1mol/L×250g/mol=12.5 g,所以答案是:12.5;
③
Fe+ | CuSO4=FeSO4+ | Cu | △m |
1 | 8 | ||
n | (46.6g﹣45.0g) |
n=0.2mol,反应后溶液的体积不变,仍为0.1L,则所得溶液中FeSO4的物质的量浓度为 ![]() =2 mol/L,
=2 mol/L,
所以答案是:2.
【考点精析】本题主要考查了配制一定物质的量浓度的溶液的相关知识点,需要掌握配制物质的量浓度溶液时,先用烧杯加蒸馏水至容量瓶刻度线1cm~2cm后,再改用交投滴管加水至刻度线才能正确解答此题.


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案科目:高中化学 来源: 题型:
【题目】下列有关常见的几种金属氧化物的性质和用途的说法不正确的是( )
A. 氧化钙可用作干燥剂 B. Fe2O3可用于制作红色油漆和涂料
C. MgO和Al2O3可用作耐高温材料 D. Na2O2、CuO、FeO都能溶于水,且与水反应都生成相应的碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2]是一种重要的化工原料,用途十分广泛。它可以作净水剂,在无机化学工业中,它是制取其它铁化合物的原料。
【査阅资料】隔绝空气加热至500℃时硫酸亚铁铵能完全分解,分解产物中含有铁氧化物、硫氧化物、氨气和水蒸气等。
【实验探究】某化学小组选用下图所示部分装置进行实验(部分夹持装置略)
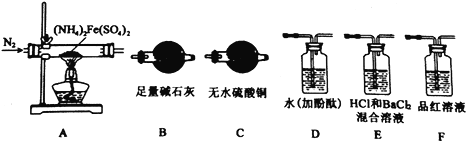
(1)验证分解产物中含有氨气和水蒸气,并探究残留固体成分。
①所选用装置的正确连接顺序为(________)。
A.A-B-C-D B.A-C-B-D C.A-D-B-C D.A-D-C-B
②取A中残留固体,加入适量稀硫酸,使其完全溶解得到溶液B,下列哪组实验能够证明A中残留固体仅为Fe2O3,而不含FeO或Fe3O4(________)
A.向溶液B中滴加酸性高锰酸钾溶液,高锰酸钾溶液不褪色
B.向溶液B中加入苯酚,溶液呈紫色
C.向溶液B中通入足量氯气,加入硫氰酸钾溶液变红色
D.向溶液B中加入铁氰化钾溶液,无现象
(2)探究分解产物中的硫氧化物,连接装置A—E—F—B进行实验。
①实验过程中观察到:E中没有明显现象,F中溶液褪色,据此得出该硫化物是__________。
②实验证明(NH4)2Fe(SO4)2受热分解除上述产物外,还有N2生成,写出A中反应的化学方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世界第一条大面积碲化镉薄膜“发电玻璃”生产线最近在成都投产,该材料是在玻璃表面镀一层碲化镉薄膜,光电转化率高。下列说法错误的是
A.普通玻璃含有二氧化硅B.该发电玻璃能将光能不完全转化为电能
C.碲化镉是一种有机化合物D.应用该光电转化技术可减少温室气体排放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置,将溶液A逐滴加入固体B中,下列叙述正确的是( )
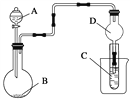
A. 若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色
B. 若A为醋酸,B为贝壳,C中盛过量澄清石灰水,则C中溶液变浑浊
C. 若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解
D. 若A为浓硫酸,B为Na2SO3固体,C中盛石蕊试液,则C中溶液先变红后褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100℃时,将0.1 mol N2O4置于1L密闭的烧瓶中,然后将烧瓶放入100℃ 的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g)![]() 2NO2 (g)。
2NO2 (g)。
下列结论不能说明上述反应在该条件下已经达到平衡状态的是 ( )
①N2O4的消耗速率与NO2的生成速率之比为1:2 ②NO2生成速率与NO2消耗速率相等 ③烧瓶内气体的压强不再变化 ④烧瓶内气体的质量不再变化 ⑤NO2的物质的量浓度不再改变 ⑥烧瓶内气体的颜色不再加深 ⑦烧瓶内气体的平均相对分子质量不再变化 ⑧烧瓶内气体的密度不再变化。
A. ②③⑤⑥⑦ B. ①④⑧ C. ④⑥⑦ D. 只有②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】给定条件下,下列选项中所示的物质间转化均能一步实现的是( )
A. 粗硅![]() SiCl4
SiCl4![]() Si
Si
B. Mg(OH)2![]() MgCl2(aq)
MgCl2(aq)![]() Mg
Mg
C. Fe2O3![]() FeCl3(aq)
FeCl3(aq)![]() 无水FeCl3
无水FeCl3
D. AgNO3(aq)![]() [Ag(NH3)2]OH(aq)
[Ag(NH3)2]OH(aq)![]() Ag
Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是周期表中的一部分,根据①﹣⑩在周期表中的位置,用元素符号或化学式回答下列问题:
族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | |||||||
2 | ④ | ⑦ | ⑧ | ⑩ | ||||
3 | ② | ③ | ⑤ | ⑥ | ⑨ |
(1)表中元素,化学性质最不活泼的是 , 只有负价而无正价的是 , 还原性最强的单质是 , 可用于制半导体材料的元素是;
(2)最高价氧化物的水化物酸性最强的是 , 呈两性的是 , 最高价氧化物的水化物碱性最强的是 , 电子式为;
(3)在②、③、④、⑤、⑥、⑦、⑧、⑨中,原子半径最大的是;
(4)比较⑥⑦⑨氢化物的稳定性最弱的是;
(5)③元素单质和②元素最高价氧化物对应的水化物相互反应的离子方程式为;
(6)铍(Be)位于元素周期表中第二周期第ⅡA族.相同条件下,单质铍与酸反应比单质锂与酸反应更加(填“剧烈”或“缓慢”),写出铍与盐酸反应的化学方程式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com