
【题目】第三周期元素中金属性最强的是( )
A. Al B. Cl C. Na D. Si
科目:高中化学 来源: 题型:
【题目】氨气是一种重要的物质,可用于制取化肥和硝酸等.已知H﹣H键、N﹣H键、N≡N键的键能分别是436kJ/mol、391kJ/mol、946kJ/mol.
(1)写出合成氨的热反应方程式 .
生成1molNH3需要吸收或放出kJ
(2)当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如右图所示.图中t1 时引起平衡移动的条件可能是 . 其中表示平衡混合物中NH3的含量最高的一段时间是 . 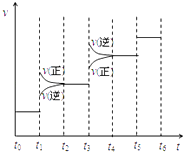
(3)温度为T℃时,将2a molH2和a molN2放入0.5L密闭容器中,充分反应后测得N2的转化率为50%.则该反应的平衡常数为 .
(4)已知373K时,可逆反应平衡常数为K=0.12,若某时刻时,测得 C(N2)=1mol/L,C(H2)=3mol/L,C(NH3)=2mol/L.此刻可逆反应
A.向正方向进行
B.向逆方向进行 C处于平衡状态.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL 0.50molL﹣1盐酸与50mL 0.55molL﹣1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: 
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是 .
(2)烧杯间填满碎泡沫塑料的作用是 .
(3)理论上稀的强酸溶液与强碱溶液反应生成1mol水时放出57.3kJ的热量,写出表示稀盐酸和稀氢氧化钠溶液反应的中和热的热化学方程式:
(4)大烧杯上如不盖硬纸板,求得的中和热数值(填“偏大”、“偏小”或“无影响”).
(5)实验中改用60mL 0.50molL﹣1盐酸与50mL 0.55molL﹣1 NaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等”或“不相等”),所求中和热(填“相等”或“不相等”),简述理由: .
(6)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会(填“偏大”“偏小”或“无影响”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下CO2、H2、CO的混合气体与氮气的密度相同,则该混合气体中CO2、H2、CO的质量之比可能为( )
A.13:8:27
B.13:9:27
C.26:16:27
D.286:8:27
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是____________。
(2)已知0.2mol KBrO3在反应中得到1mol电子生成X,则X的化学式为____________。
(3)根据上述反应可推知___________。
a.氧化性:H3AsO4>KBrO3
b.氧化性:KBrO3>H3AsO4
c.还原性:X>AsH3
d.还原性:AsH3>X
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目___________
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 原电池中的电极一定要由两种不同的金属组成
B. 原电池两极均发生氧化还原反应
C. 原电池中电子流出的一极是正极,发生氧化反应
D. 原电池中阳离子向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是可逆反应 2Y2Z2 在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( ) 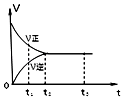
A.t1时,只有正方向反应
B.t2﹣t3 , 反应不再发生
C.t2﹣t3 , 各物质的浓度均没有发生变化
D.t2时,反应到达限度,正反应和逆反应速率相等且等于零
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在m毫升b摩/升AlCl3溶液中加入等体积a摩/升NaOH溶液。
(1)当0<a≤3b时,生成Al(OH)3沉淀的物质的量是_______________。
(2)当 a=3b时, 生成沉淀 _______ 克
(3)当a,b满足___________条件时,无沉淀生成。
(4)当3b≤a<4b时,有沉淀生成,生成Al(OH)3沉淀的质量是__________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com