
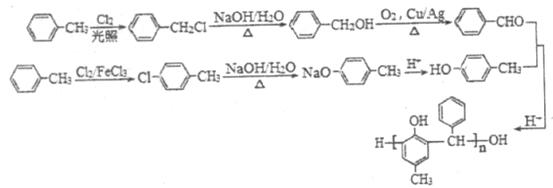
����Ŀ���ϳ�ҽ������ҩ��������E��ʳƷ������J��·����ͼ��ʾ��

��֪��
��ش��������⣺
��1��A���ڷ��������ṹ��ʽΪ_____________��
��2��E�й����ŵ������ǰ�����____________��
��3��C����NaHCO3��Һ��Ӧ����Ӧ�۵Ļ�ѧ����ʽ��___________��
��4����Ӧ�ޡ������Լ�ii���Լ�iii������ ___________��___________��
��5����Ӧ��~���У�����ȡ����Ӧ����_______________��
��6��J�ж���ͬ���칹�壬���з�������������ͬ���칹����______________�֣�д��������һ��ͬ���칹��Ľṹ��ʽ��___________��
a. Ϊ���Ķ�Ԫȡ�������һ��ȡ����Ϊ�ǻ�
b. �������࣬���ܷ���������Ӧ
��7����AΪ��ʼԭ�ϣ�ѡ�ñ�Ҫ�����Լ��ϳɸ߷�����֬�� ����д���ϳ�·�ߣ��ýṹ��ʽ��ʾ�л���ü�ͷ��ʾת����ϵ����ͷ��ע���Լ��ͷ�Ӧ��������_______________��
����д���ϳ�·�ߣ��ýṹ��ʽ��ʾ�л���ü�ͷ��ʾת����ϵ����ͷ��ע���Լ��ͷ�Ӧ��������_______________��
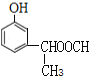
���𰸡� ![]() ����������
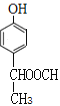
���������� ![]() ���Ը��������Һ NaOH/H2O �٢ۢݢ� 6 �����½ṹ��дһ�֣�
���Ը��������Һ NaOH/H2O �٢ۢݢ� 6 �����½ṹ��дһ�֣�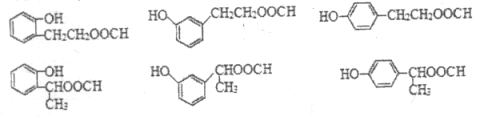
��·�ߺ������ɣ�
��������������������⿼���л��ƶϺ��л��ϳɣ��漰�л�������ŵ�ʶ���л���ṹ��ʽ���л���Ӧ����ʽ����д���л���Ӧ���͵��жϣ���������ͬ���칹����Ŀ��ȷ������д���л��ϳ�·�ߵ���ơ�A���ڷ�������A������Ӧ������B��A�Ľṹ��ʽΪ![]() ���Ա�B��E�Ľṹ��ʽ�Լ���Ӧ������������Ӧ���ǽ�-NO2��ԭΪ-NH2��D�Ľṹ��ʽΪ
���Ա�B��E�Ľṹ��ʽ�Լ���Ӧ������������Ӧ���ǽ�-NO2��ԭΪ-NH2��D�Ľṹ��ʽΪ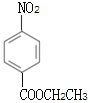 ��C����NaHCO3��Һ��Ӧ��C�к��Ȼ�����Ӧ��Ϊ�����Ը��������Һ��B��-CH3������-COOH��C�Ľṹ��ʽΪ
��C����NaHCO3��Һ��Ӧ��C�к��Ȼ�����Ӧ��Ϊ�����Ը��������Һ��B��-CH3������-COOH��C�Ľṹ��ʽΪ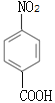 ����Ӧ��ΪC��CH3CH2OH��������Ӧ���Լ�iΪCH3CH2OH��Ũ���������F�ķ���ʽ����Ӧ��ΪA��Cl2�ڴ��������·��������ϵ�ȡ����Ӧ������J�������������ڶ�λ����F�Ľṹ��ʽΪ
����Ӧ��ΪC��CH3CH2OH��������Ӧ���Լ�iΪCH3CH2OH��Ũ���������F�ķ���ʽ����Ӧ��ΪA��Cl2�ڴ��������·��������ϵ�ȡ����Ӧ������J�������������ڶ�λ����F�Ľṹ��ʽΪ![]() �� �����Լ�iΪCH3CH2OH��Ũ���ᣬ��J���Ƴ�I�Ľṹ��ʽΪ
�� �����Լ�iΪCH3CH2OH��Ũ���ᣬ��J���Ƴ�I�Ľṹ��ʽΪ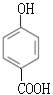 ���Ա�F��I�Ľṹ��ʽ��Fת��ΪI��Ҫ��-CH3������-COOH����-Clˮ��ɷ��ǻ������ڷ��ǻ�Ҳ����������Ӧ��Ϊ�˱������ǻ�������������Ӧ��Ϊ������Ӧ����Ӧ��Ϊˮ�ⷴӦ�����Լ�iiΪ����KMnO4��Һ��G�Ľṹ��ʽΪ
���Ա�F��I�Ľṹ��ʽ��Fת��ΪI��Ҫ��-CH3������-COOH����-Clˮ��ɷ��ǻ������ڷ��ǻ�Ҳ����������Ӧ��Ϊ�˱������ǻ�������������Ӧ��Ϊ������Ӧ����Ӧ��Ϊˮ�ⷴӦ�����Լ�iiΪ����KMnO4��Һ��G�Ľṹ��ʽΪ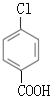 ���Լ�iiiΪNaOH��Һ��H�Ľṹ��ʽΪ
���Լ�iiiΪNaOH��Һ��H�Ľṹ��ʽΪ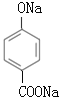 ��
��
��1��A���ڷ�������A�Ľṹ��ʽΪ![]() ��
��
��2����E�Ľṹ��ʽ��֪��E�й����ŵ�����Ϊ������������
��3��C�Ľṹ��ʽΪ ����Ӧ��ΪC��CH3CH2OH��������Ӧ����Ӧ�Ļ�ѧ����ʽΪ��
����Ӧ��ΪC��CH3CH2OH��������Ӧ����Ӧ�Ļ�ѧ����ʽΪ�� +CH3CH2OH
+CH3CH2OH![]()
 +H2O��
+H2O��
��4����Ӧ���ǽ�![]() ��-CH3������-COOH���Լ�ii�����Ը��������Һ����Ӧ����
��-CH3������-COOH���Լ�ii�����Ը��������Һ����Ӧ���� ��ˮ�ⷴӦ���Լ�iii��NaOH��Һ��
��ˮ�ⷴӦ���Լ�iii��NaOH��Һ��
��5����Ӧ��~������Ϊȡ����Ӧ��������Ӧ��ȡ����Ӧ����ԭ��Ӧ��ȡ����Ӧ��������Ӧ��ȡ����Ӧ������ȡ����Ӧ�����٢ۢݢ���
��6��J�Ľṹ��ʽΪ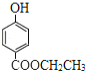 ��J��ͬ���칹�������������ܷ���������Ӧ����ṹ�к���HCOO-��J��ͬ���칹��Ϊ���Ķ�Ԫȡ�������һ��ȡ����Ϊ-OH������������ͬ���칹��������1��������ȡ����Ϊ-OH��-CH2CH2OOCH�����ڡ��䡢������λ�ã��ṹ��ʽΪ
��J��ͬ���칹�������������ܷ���������Ӧ����ṹ�к���HCOO-��J��ͬ���칹��Ϊ���Ķ�Ԫȡ�������һ��ȡ����Ϊ-OH������������ͬ���칹��������1��������ȡ����Ϊ-OH��-CH2CH2OOCH�����ڡ��䡢������λ�ã��ṹ��ʽΪ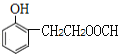 ��
��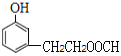 ��
��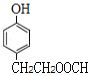 ����2��������ȡ����Ϊ-OH��-CH��CH3��OOCH�����ڡ��䡢������λ�ã��ṹ��ʽΪ
����2��������ȡ����Ϊ-OH��-CH��CH3��OOCH�����ڡ��䡢������λ�ã��ṹ��ʽΪ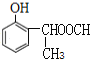 ��
�� ��
�� ������������ͬ���칹�干6�֡�
������������ͬ���칹�干6�֡�
��7��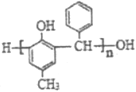 �ɵ���
�ɵ���![]() ��
��![]() �������۷�Ӧ�Ƶã��ϳ�
�������۷�Ӧ�Ƶã��ϳ� ��Ҫ��
��Ҫ��![]() �ϳ�
�ϳ�![]() ��
��![]() ����
����![]() �ϳ�
�ϳ�![]() ����Ҫ��-CH3�Ķ�λ����-OH������
����Ҫ��-CH3�Ķ�λ����-OH������![]() ��Cl2�ڴ��������·��������ϵ�ȡ����Ӧ����
��Cl2�ڴ��������·��������ϵ�ȡ����Ӧ����![]() ��Ȼ��
��Ȼ��![]() ��NaOH��Һ�з���ˮ�ⷴӦ����
��NaOH��Һ�з���ˮ�ⷴӦ����![]() ��
��![]() �ữ��
�ữ��![]() ����
����![]() �ϳ�
�ϳ�![]() ���ڲ�������������ţ�����
���ڲ�������������ţ�����![]() ��Cl2�ڹ����·��������ϵ�ȡ����Ӧ����
��Cl2�ڹ����·��������ϵ�ȡ����Ӧ����![]() ��
��![]() ��NaOH��Һ�з���ˮ�ⷴӦ����
��NaOH��Һ�з���ˮ�ⷴӦ����![]() ��
��![]() ��������������
��������������![]() ���ϳ�·��Ϊ��
���ϳ�·��Ϊ��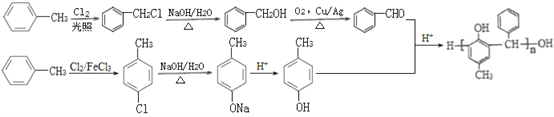 ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2.0mol PCl3��1.0mol Cl2�������������ܱ������У���һ�������·���������Ӧ��PCl3+Cl2![]() PCl5����ƽ��ʱ��PCl5Ϊ0.40mol�������ʱ����1.0mol PCl3��0.50mol Cl2������ͬ�¶����ٴ�ƽ��ʱPCl5�����ʵ����ǣ� ��
PCl5����ƽ��ʱ��PCl5Ϊ0.40mol�������ʱ����1.0mol PCl3��0.50mol Cl2������ͬ�¶����ٴ�ƽ��ʱPCl5�����ʵ����ǣ� ��
A. 0.40mol B. 0.20mol
C. ��0.20mol D. ����0.20mol����0.40mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȷ��ʾ���з�Ӧ�����ӷ���ʽ���� ��
A. Fe3O4 ��������ϡHNO3��Fe3O4+8H+=Fe2++2Fe3++4H2O
B. ���Ƶ�ˮ�ⷴӦ��S2-+H3O+![]() HS-+H2O
HS-+H2O
C. ��0.2mol/L��NH4Al(SO4)2��Һ��0.3mol/L��Ba(OH)2��Һ����������2Al3++3SO42-+3Ba2++6OH-=2A1(OH)3��+3BaSO4��
D. NH4HCO3��Һ������Ba(OH)2��Һ�����HCO3-+Ba2++OH-=BaCO3��+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�����������Һ���ܹ�����ͨ����������Ӧ��������ܴ������ڵ��ǣ� ��
A.Na+��Ba2+��HSO3����I����������
B.Ca2+��NO3����Na+��Cl������������
C.Fe3+��SO42����CO32����NO3����������
D.Na+��K+��HCO3����Cl����������̼��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ж��ֺ����ᣬ�ڹ�ҵ���й㷺��Ӧ�ã�������ͬ��Ҳ����Ҫ�Ļ�����Ʒ��
��.���������( Na2S2O3)�����������Լ������ﻹԭ���������ȡ������ֽ⡣��ҵ�ϳ����ú����ˮ����Na2S2O3��5H2O��ʵ���ҿ�������װ��ģ�����ɹ��̣�
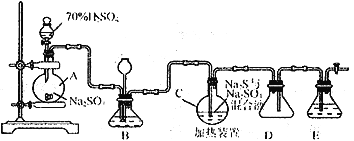
��ƿC�з�����Ӧ������
Na2S(aq)+H2O(l)+SO2(g)==NaSO3(aq)+H2S(aq)������
2H2S(aq)+SO2(g)=3S(s)+2H2O(l)������
S(s)+Na2SO3(aq) ![]() Na2S2O3(aq)������
Na2S2O3(aq)������
��1����ƿA�з�����Ӧ�����ӷ���ʽΪ_________________________________��װ��D��������__________________________��
��2��װ��B������֮һ�ǹ۲�SO2���������ʣ����е�Һ�����ѡ��_____________��
a.����ˮ b.����Na2SO3��Һ c.����NaHSO3��Һ d.����NaHCO3��Һ
��3����Ӧ���ڿ��þƾ����ʵ�������ƿA��ʵ�����þƾ��Ƽ���ʱ����ʹ��ʯ��������������______
a.�ձ� b.��� c.�Թ� d.��ƿ
��4��Ϊ�˱�֤Na2S2O3�IJ�����ʵ����ͨ��SO2���ܹ�����ԭ����_____________________��
��.����������(Na2S2O5)�dz��õ�ʳƷ��������֮һ��(Na2S2O5����ˮ������NaHSO3��
��5��֤��NaHSO3��Һ��HSO3-����̶ȴ���ˮ��̶ȣ��ɲ��õ�ʵ�鷽����________________��
a.�ⶨ��Һ��pH b.����Ba(OH)2��Һ c. .��������
d.����Ʒ����Һ e.����ɫʯ����ֽ���
��6�����ѾƳ���Na2S2O5�������������ⶨ�����Ѿ��п��������IJ�������������SO2�������ķ�����������֪���ζ�ʱ��Ӧ�Ļ�ѧ����ʽΪSO2+I2+2H2O=H2SO4+2HI����
![]()
������������ʵ�飬���ı�I2��Һ25.00mL���ô�ʵ������Ʒ�п��������IJ�������������SO2������Ϊ______g/L
��������ʵ������У�HI���ܻᱻ������������Ӧ�Ļ�ѧ����ʽΪ_____________________________�����в���HI�������������ᵼ�²�õĽ��_______������ƫ������ ƫ������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݺϳɰ���Ӧ�������仯ʾ��ͼ�������й�˵����ȷ����

A. N2(g)+3H2(g)=2NH3(g) ��H=-2(a-b)kJ��mol-1
B. ����0.5moIN2 (g)��1.5molH2(g)�����еĻ�ѧ���ͷ�akJ����
C. 2NH3 (l)= N2(g)+3H2(g) ��H=2(b+c-a) kJ��mol-1
D. ���ϳɰ���Ӧʹ�ô�������Ӧ�ų�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ʵ�����X(g)��Y(g)���ܱ������н��п��淴Ӧ��X(g)��Y(g) ![]() 2Z(g)��W(s)����H<0������������ȷ����
2Z(g)��W(s)����H<0������������ȷ����
A. �ﵽƽ��������¶Ȼ�����ѹǿ�������ڸ÷�Ӧƽ�����淴Ӧ�����ƶ�
B. �ﵽƽ������¶ȣ�����Ӧ���ʼ�С�ı�����������Ӧ���ʼ�С�ı���
C. �ﵽƽ��ʱ����Ӧ����v��(X)��2v��(Z)
D. ƽ�ⳣ��KֵԽ��X��ת����Խ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ѧ�ҷ�����һ�����Ϳɿص�ء����ˮ���,����ԭ����ͼ��ʾ�������й�˵������ȷ����(����)

A. ʯī�������ķ�Ӧ��2H2O+2e�� === H2��+2OH��
B. �л�����ʺ�ˮ��Һ�����Ի�������
C. ��װ�ò������ṩ����,���ɵõ���������
D. ��״���²���22.4 L������ʱ,��������﮵�����Ϊ14 g
���𰸡�D
��������A������ͼʾ��Ϣ��֪,ʯī�缫�ϲ���H2����ʯī�缫Ϊ�������缫��ӦΪ��2H2O+2e=H2��+2OH����A��ȷ��B��Li���л�����ʲ���Ӧ����Li��ˮ��Ӧ����Li��ˮ�Ӵ������в��ֻ�ѧ��ֱ��ת��Ϊ���ܣ������л�����ʺ�ˮ��Һ�����Ի�����B��ȷ��C����ԭ����ǽ���ѧ��ת��Ϊ���ܵ�װ�ã�װ�ò������ṩ���ܣ����ҷ�Ӧ���������������ṩ����Դ����C��ȷ��D��������Ǹ�������D��������ѡD��
�����͡���ѡ��
��������
26
����Ŀ��һ�����͵ġ��-����CO2��ء����ṹ��ͼ��ʾ������˵������ȷ����

A. ��װ���ǻ�ѧ��ת��Ϊ����
B. ���øü����ɼ�����������CO2���ŷ�
C. �����ĵ缫��ӦΪ��2CO2 + 2e- = C2O42-
D. ÿ����10.2g Li2C2O4����0.2mol Li+������Ǩ��������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com