
【题目】下列表述正确的是( )
①浓硝酸通常保存在棕色试剂瓶中
②检验亚硫酸钠溶液在空气中放置是否变质可以先加硝酸溶液,再加氯化钡溶液来检验
③锌与稀硝酸反应可以得到氢气
④浓硫酸滴到纸张上变黑,说明浓硫酸具有吸水性
⑤二氧化硫和二氧化氮都能形成酸雨,酸雨的pH等于5.6
A.①③B.①②C.①D.①②④⑤
科目:高中化学 来源: 题型:
【题目】下列每一方框中的字母代表一种反应物或生成物:
物质A跟B反应生成物质E、F和G;物质C跟D反应生成物质I,其中B是一种黄氯色气体,C是一种可燃性气体,D气体是空气的主要成分之一,I的水溶液显碱性.请填写下列空白: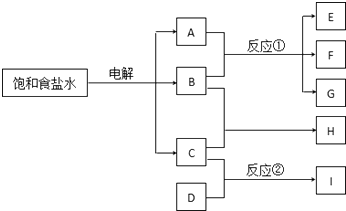
(1)物质H的化学式是 .
(2)写出电解饱和食盐水的反应方程式:
(3)分别写出电解过程中产生B、C气体的电极反应式:、
(4)反应①的化学方程式是 .
(5)反应②的化学方程式(应注明反应条件)是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填空
(1)有机物 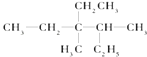 用系统命名法命名:
用系统命名法命名:
(2)写出4甲基2乙基1戊烯的结构简式:
(3)某烃的结构简式是 ![]() ,分子中饱和碳原子数为 , 可能在同一平面上的碳原子数最多为
,分子中饱和碳原子数为 , 可能在同一平面上的碳原子数最多为
(4)下列物质中属于同系物的是
①CH3CH2Cl②CH2═CHCl ③CH3CH2CH2Cl④CH2ClCH2Cl⑤CH3CH2CH2CH3 ⑥CH3CH(CH3)2
A.①②
B.①④
C.①③
D.⑤⑥
(5)0.1mol某烷烃燃烧,其燃烧产物全部被碱石灰吸收,碱石灰增39g.该烃的分子式为;若它的核磁共振氢谱共有3个峰,则该烃可能的结构简式为 . (写出其中一种即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化合物6.4g在O2中完全燃烧,只生成8.8g CO2和7.2g H2O.下列说法正确的是( )
A.该化合物仅含碳、氢两种元素
B.该化合物中碳、氢原子个数比为1:2
C.无法确定该化合物是否含有氧元素
D.该化合物中一定含有氧元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有Al、CuO、Fe2O3组成的混合物共10.0g,放入250mL某浓度的硫酸溶液中,混合物完全溶解,当再加入125mL 2.00mol/L的NaOH溶液时,得到沉淀物质的量最多.上述硫酸溶液的浓度为( )
A.0.500 mol/L
B.1.00 mol/L
C.2.00 mol/L
D.3.00 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+F2(g)=2HF(g)△H=﹣270kJ/mol,下列说法正确的是( )
A.在相同条件下,1mol H2与1mol F2的能量总和大于2mol HF气体的能量
B.1mol H2与1mol F2反应生成2mol液态HF放出的热量小于270kJ
C.该反应的逆反应是放热反应
D.该反应过程的能量变化可用如图来表示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水的综合利用包括很多方面,下图是从海水中通过一系列工艺流程提取产品的流程图。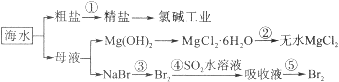
海水中主要含有Na+、K+、Mg2+、Ca2+、Cl-、Br-、SO42-、HCO3-等离子。
已知:MgCl2·6H2O受热生成Mg(OH)Cl和HCl气体等。回答下列问题:
(1)海水pH约为8的原因主要是天然海水含上述离子中的。
(2)除去粗盐溶液中的杂质(Mg2+、SO42-、Ca2+),加入药品的顺序可以为。
①NaOH溶液 ②BaCl2溶液 ③过滤后加盐酸 ④Na2CO3溶液
(3)过程②中由MgCl2·6H2O制得无水MgCl2 , 应如何操作。
(4)从能量角度来看,氯碱工业中的电解饱和食盐水是一个将转化为的过程。采用石墨阳极,不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为;电解时,若有少量水存在会造成产品镁的消耗,写出有关反应的化学方程式。
(5)从第③步到第④步的目的是。采用“空气吹出法”从浓海水中吹出Br2 , 并用SO2吸收。主要反应的化学方程式为。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关水的电离的说法正确的是
A.将水加热,KW增大,pH不变
B.向水中加入少量NaHSO4固体,恢复到原温度,水的电离程度增大
C.向水中加入少量NH4Cl固体,恢复到原温度,水的电离程度减小
D.向水中加少量NaOH固体,恢复到原温度,水的电离被抑制,[OH-]增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com