
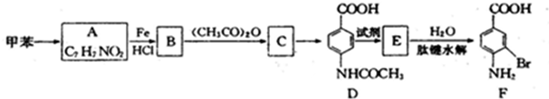
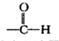 ②苯环上有两个取代基,且处于对位
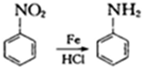
②苯环上有两个取代基,且处于对位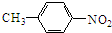 ,A发生信息中反应,硝基被还原为氨基生成B,则B的结构简式为
,A发生信息中反应,硝基被还原为氨基生成B,则B的结构简式为 ,结合D的结构可知,B中氨基中1个H原子被取代生成C为
,结合D的结构可知,B中氨基中1个H原子被取代生成C为 ,C被酸性高锰酸钾溶液氧化生成D,对比D、F的结构可知,D与液溴发生取代反应生成E为
,C被酸性高锰酸钾溶液氧化生成D,对比D、F的结构可知,D与液溴发生取代反应生成E为 ,E发生水解反应得到F,据此答题.
,E发生水解反应得到F,据此答题. ,A发生信息中反应,硝基被还原为氨基生成B,则B的结构简式为
,A发生信息中反应,硝基被还原为氨基生成B,则B的结构简式为 ,结合D的结构可知,B中氨基中1个H原子被取代生成C为
,结合D的结构可知,B中氨基中1个H原子被取代生成C为 ,C被酸性高锰酸钾溶液氧化生成D,对比D、F的结构可知,D与液溴发生取代反应生成E为
,C被酸性高锰酸钾溶液氧化生成D,对比D、F的结构可知,D与液溴发生取代反应生成E为 ,E发生水解反应得到F,
,E发生水解反应得到F, ,B的名称是对氨基甲苯;F中含氧官能团的名称是羧基,故答案为:对氨基甲苯;羧基;
,B的名称是对氨基甲苯;F中含氧官能团的名称是羧基,故答案为:对氨基甲苯;羧基; ,C中核磁共振氢谱显示有5个吸收峰,B→C的化学方程式是
,C中核磁共振氢谱显示有5个吸收峰,B→C的化学方程式是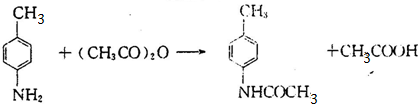 ,E→F的化学方程式是
,E→F的化学方程式是 ,
, ;
; ;
; ,同时符合下列条件①分子中含有
,同时符合下列条件①分子中含有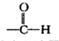 ②苯环上有两个取代基,且处于对位,A的同分异构体的结构简式为
②苯环上有两个取代基,且处于对位,A的同分异构体的结构简式为 ,故答案为:
,故答案为: ;
;

 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
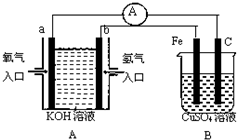 根据如图所示装置回答问题:
根据如图所示装置回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属钠与水反应:Na+2H2O=Na++2OH-+H2↑ |
| B、金属铝投入NaOH溶液中:Al+2OH-=AlO2-+H2↑ |
| C、稀硝酸中加入过量铁粉:Fe+4H++NO3-=Fe3++NO↑+2H2O |
| D、FeCl2酸性溶液放在空气中变质:4Fe2++4H++O2=4Fe3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
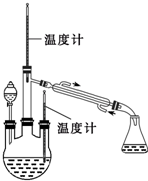 肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4?H2O).CO(NH2)+2NaOH+NaClO=Na2CO3+N2H4?H2O+NaCl
肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4?H2O).CO(NH2)+2NaOH+NaClO=Na2CO3+N2H4?H2O+NaCl查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃时,等体积、等浓度的NaX和弱酸HX混合后的溶液中:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-) |
| B、常温下,pH≈5.5的0.1mol/LNaHC2O4溶液:c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-) |
| C、0.1mol/LNaHS溶液:c(OH-)+c(S2-)=c(H+)+c(H2S) |
| D、室温下,向0.1mol/LNH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 | B、2 | C、3 | D、4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
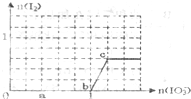 已知:还原性还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法正确的是( )
已知:还原性还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法正确的是( )| A、反应过程中的氧化产物均为SO3 |
| B、a点时剩余NaHSO3的物质的量为1.2 mol |
| C、b点时的还原产物可能是KI或NaI |
| D、当溶液中I-与I2的物质的量之比为1:1时,加入的KIO3为1.1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、升高温度该反应的正反应速率增大,逆反应速率减小 | ||
B、该反应的化学平衡常数表达式为K=
| ||
| C、绝热容器中进行该反应,温度不再变化,则达到化学平衡状态 | ||
| D、该反应的正反应是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
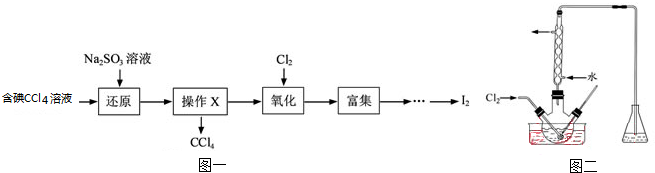
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g?L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com