
【题目】一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3=2HNO3+4N2+9H2O,在反应中氧化产物与还原产物的物质的量之比为 A
A.5∶3 B.5∶4 C.1∶1 D.3∶5
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】SO2(g)+NO2(g)![]() SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示。下列说法正确的是
SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示。下列说法正确的是
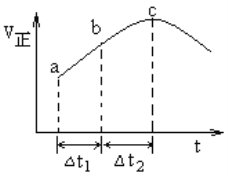
A. 反应物浓度:a点小于b点
B. 反应物的总能量大于生成物的总能量
C. △t1=△t2时,SO2的转化率:a~b段大于b~c段
D. 反应进行到c点达平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物在氧气中充分燃烧,生成的二氧化碳和水的物质的量之比为1 :1,由此可得出的正确结论是( )
A. 该有机物分子中碳、氢、氧原子个数比为1 :2 :3
B. 该有机物分子中碳、氢原子个数比为1 :1
C. 该有机物中肯定含氧
D. 无法判断该有机物中是否含氧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析下图所示的四个原电池装置,其中结论正确的是

A.①②中Mg作负极,③④中Fe作负极
B.②中Mg作正极,电极反应式为6H2O+6e-===6OH-+3H2↑
C.③中Fe作正极,电极反应式为Fe-2e-===Fe2+
D.④中Cu作正极,电极反应式为2H++2e-===H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列固体混合物与过量的稀H2SO4反应,能产生气泡并有沉淀生产的是( )
A.NaHCO3和Al(OH)3
B.BaCl2和NaCl
C.KClO3和K2SO4
D.Na2SO3和BaCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质分类是化学研究的重要方法之一。近年来发现,在金星大气层中存在三氧化二碳。下列物质与它属于同类的是
A.SO2、NO B.H2SO4、H2CO3
C.H2、O3 D.Na2SO3、KClO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组在通过反应Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O研究反应速率的影响因素后,对Na2S2O3产生了兴趣,查资料知Na2S2O3的名称为硫代硫酸钠,可视为一个S原子取代了Na2SO4中的一个O原子。该实验小组运用类比学习的思想预测了Na2S2O3的某些性质,并通过实验探究了自己的预测。
【提出假设】
(1)部分学生认为Na2S2O3与Na2SO4结构相似,化学性质也相似,因此室温时Na2S2O3溶液的pH____7(填“>”、“=”或“<”)。
(2)部分学生从S元素化合价推测Na2S2O3与Na2SO4性质相似,均具有较强的____。
【实验探究】取适量Na2S2O3晶体,溶于水中制成Na2S2O3溶液,进行如下探究(填写表中空格)。
实验操作 | 实验现象 | 现象解释(用离子方程式表示) | |
探究① | (3)____ | 溶液pH=8 | (4)____ |
探究② | 向新制氯水(pH<2)中滴加少量Na2S2O3溶液 | 氯水颜色变浅 | (5)____ |
【实验结论】
(6)探究①__________。
(7)探究②__________。
【问题讨论】
(8)甲同学向“探究②”反应后的溶液中滴加硝酸银溶液,观察到有白色沉淀产生,并据此认为氯水可将Na2S2O3氧化。你认为该方案是否正确并说明理由___________。
(9)请你重新设计一个实验方案,证明Na2S2O3被氯水氧化。你的方案是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关酶的叙述,正确的是
A. 酶的基本组成单位酸或脱氧核苷酸 B. 酶为反应过程供能从而降低反应活化能
C. 酶在活细胞以外不具有催化活性 D. 酶可以是其他酶促反应的的底物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com