
在温度t1和t2下,卤素单质X2(g)和H2反应生成HX的化学平衡常数如下表,仅根据下表数据不能判断的是

A.已知t2>t1,HX的生成反应为放热反应
B.在相同条件下, X2平衡转化率:F2>Cl2
C.X2与H2反应的剧烈程度随着原子序数递增逐渐减弱
D.HX的稳定性:HBr>HI
科目:高中化学 来源:2014-2015学年上海市静安区高三上学期期末教学质量检测化学试卷(解析版) 题型:选择题
某稀土元素R的精矿样品中,R的氧化物的质量分数为0.8515。20.2g该样品与100 mL 1mol/L稀硫酸恰好完全反应(杂质不反应),生成ROSO4和H2O,则R的相对原子质量约为
A.78 B.140 C.156 D.172
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省高三12月月考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.石墨比金刚石稳定,故石墨转化为金刚石的反应可以自发进行
B.吸热反应能自发进行的原因是从外界获得了能量
C.Si02常温下可以与NaOH溶液和HF溶液反应,说明其具有两性
D.反应A(g)+B(g)=2C(s)可以自发进行,则其必为放热反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省高三12月月考化学试卷(解析版) 题型:选择题
赤铜矿的成份是Cu2O,辉铜矿的成份是Cu2S,将赤铜矿与辉铜矿混合加热有以下反应:2Cu2O+Cu2S  6Cu+SO2↑,对于该反应,下列说法正确的是
6Cu+SO2↑,对于该反应,下列说法正确的是
A.该反应的氧化剂只有Cu2O
B.Cu既是氧化产物又是还原产物
C.每生成1 mol Cu,还原剂转移给氧化剂的电子为2 mol
D.该反应中氧化产物与还原产物的质量比为1∶6
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高三1月练习理综化学试卷(解析版) 题型:填空题
(13分)(NH3经一系列反应可以得到HNO3,如下图所示。

(1)I中,NH3 和O2在催化剂作用下反应,其化学方程式是_____________________。
(2)II中,2NO(g)+O2 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如图)。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如图)。

①比较P1、P2的大小关系:________________。
②随温度升高,该反应平衡常数变化的趋势是________________。
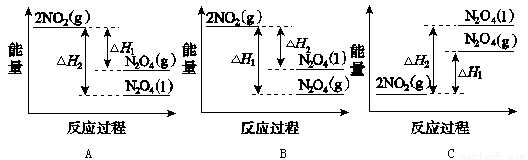
(3)III中,将NO2( )转化为N2O4(
)转化为N2O4( ),再制备浓硝酸。
),再制备浓硝酸。
①已知:2NO2( )
) N2O4(
N2O4( )△H1
)△H1
2NO2( )
) N2O4(
N2O4( ) △H2
) △H2
下列能量变化示意图中,正确的是(选填字母)_______________。
②N2O4与O2、H2O化合的化学方程式是_________________。
(4)IV中,电解NO制备 NH4NO3,其工作原理如图所示,其阳极电极反应式为_____________,为使电解产物全部转化为NH4NO3,需补充物质A,A是_____________,说明理由:________________。

查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省等五校高三上学期第二次联考理综化学试卷(解析版) 题型:填空题
[化学—选修3:物质结构与性质](15分)
已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;E+原子核外有3层电子且各层均处于全满状态。
请填写下列空白。
(1)E元素基态原子的核外电子排布式为_________________。
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为_____________(填元素符号),其原因为_____________________。
(3)B2A4是重要的基本石油化工原料。B2A4分子中B原子轨道的杂化类型为__________;
1 mol B2A4分子中含__________molσ键。
(4)已知D、E能形成晶胞如图所示的两种化合物,

化合物的化学式,甲为__________,乙为_____________;高温时,甲易转化为乙的原因为__________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省等五校高三上学期第二次联考理综化学试卷(解析版) 题型:选择题
一定温度下,难溶强电解质的饱和溶液中存在着沉淀溶解平衡,其平衡常数为
物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
Ksp(25℃) | 8.0×10﹣16 | 2.2×10﹣20 | 4.0×10﹣38 |
对于含Fe2(SO4)3、FeSO4和CuSO4各0.5mol的混合溶液1L,根据上表数据判断,说法错误的是
A.向混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀
B.向溶液中加入双氧水,并用CuO粉末调节pH,过滤后可获较纯净的CuSO4溶液
C.该溶液中c(SO42﹣):[c(Fe3+)+c(Fe2+)+c(Cu2+)]=5:4
D.将少量FeCl3粉末加入含Cu(OH)2的悬浊液中,其中c(Cu2+)增大
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高三第五次调研考试化学试卷(解析版) 题型:选择题
“富勒烯”家族又增添了新成员,继C60、C70、N60之后,中美科学家首次发现了全硼富勒烯B40。下列说法正确的是
A.B40和C70都属于新型化合物
B.C60和N60于同分异构体
C.B40、C60、N60、C70都只含共价键
D.B40、C60、N60、C70都属于烯烃
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省濉溪县高三第二次月考化学试卷(解析版) 题型:填空题
(13分)CuCl2常用于颜料、木材防腐等工业,并用作消毒剂、媒染剂、催化剂。工业上用粗制的氧化铜粉末(含杂质FeO和SiO2)来制取无水CuCl2的流程如下:

已知:Fe3+、Fe2+、Cu2+ 转化为相应的氢氧化物,开始沉淀和沉淀完全时的pH如下表:
离子符号 | Fe3+ | Fe2+ | Cu2+ |
氢氧化物开始沉淀时的pH | 2.5 | 7.0 | 4.7 |
氢氧化物完全沉淀时的pH | 3.2 | 9.7 | 6.7 |
(1)第②步反应的离子方程式为 。
(2)滤渣A的成分有 (填化学式),检验滤液C中的Fe3+ 离子是否除尽的方法是 。
(3)第④步蒸发操作必要的仪器有铁架台(含铁圈)、坩埚钳、石棉网、 。需要在氯化氢气流中蒸干制取无水氯化铜的原因是 。
(4)称取30.250g已制得的无水CuCl2产品(含少量FeCl3杂质),溶于水中,加入过量的铁粉充分反应后过滤,得250mL滤液,量取25.00mL滤液于锥形瓶中,用0.100molL-1酸性KMnO4溶液滴定至终点,消耗KMnO4溶液体积平均为46.00mL,则该无水CuCl2产品中CuCl2的质量分数为 (用小数表示,计算结果保留2位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com