
【题目】海水开发利用的部分过程如图所示.下列说法错误的是( ) 
A.向苦卤中通入Cl2是为了提取溴
B.粗盐可采用除杂和重结晶等过程提纯
C.工业生产常选用NaOH作为沉淀剂
D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
【答案】C
【解析】解:A.向苦卤中通入Cl2置换出溴单质,分离得到溴,通入Cl2是为了提取溴,故A正确;B.粗盐中含有Ca2+、Mg2+、SO42﹣等杂质,精制时通常在溶液中依次中加入过量的BaCl2溶液、过量的NaOH溶液和过量的Na2CO3溶液,过滤后向滤液中加入盐酸至溶液呈中性,再进行重结晶进行提纯,故B正确;
C.工业常选用生石灰或石灰水作沉淀剂,故C错误;
D.海水提取溴一般用氯气置换溴离子转化为溴单质,用空气和水蒸气吹出单质溴,再用SO2将其还原吸收转化为HBr,达到富集的目的,故D正确,
故选:C.
A.向苦卤中通入Cl2置换出溴单质,分离得到溴;
B.粗盐中含有Ca2+、Mg2+、SO42﹣等杂质,精制时应加入试剂进行除杂,过滤后向滤液中加入盐酸至溶液呈中性,再进行重结晶进行提纯;
C.工业常选用生石灰或石灰水作沉淀剂;
D.先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收转化为HBr,达到富集的目的.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42﹣可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室.下列叙述正确的是( ) 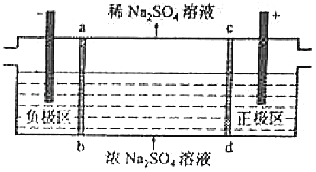
A.通电后中间隔室的SO42﹣离子向正极迁移,正极区溶液pH增大
B.该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C.负极反应为2H2O﹣4e﹣=O2+4H+ , 负极区溶液pH降低
D.当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中氧原子数目与6.8gH2O2中氧原子数目一定相等的是( )
A.6.72L CO
B.6.6gCO2
C.8gSO3
D.9.8gH2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将碱溶液A、盐溶液B按如下程序进行实验,根据下述现象判断: 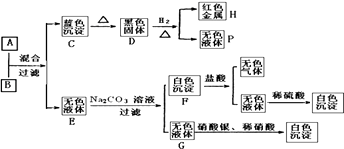
(1)A和B中溶质的化学式A;B、 .
(2)完成下列转化的化学方程式,是离子反应的只写离子方程式.
①A+B→C+E:;
②D+H2→H+P:;
③E+Na2CO3→F+G:;
④F+盐酸→I+E: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某课外活动小组的同学设计的4个喷泉实验方案.下列有关操作不可能引发喷泉现象的是( ) 
A.挤压装置①的胶头滴管使CCl4全部进入烧瓶,片刻后打开止水夹
B.挤压装置②的胶头滴管使NaOH溶液全部进入烧瓶,片刻后打开止水夹
C.用鼓气装置从装置③的a处不断鼓入空气并打开止水夹
D.向装置④的水槽中慢慢加入足量浓硫酸并打开止水夹
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型环保电池是采用低毒的铝合金(丢弃的易拉罐)、家庭常用的漂白水、食盐、氢氧化钠(化学药品店常见试剂)等原料制作的。电池的总反应方程式为2Al+3ClO-+2OH-=3Cl-+2AlO2-+H2O。下列说法不正确的是( )
A. 该电池的优点是电极材料和电解质用完后可以更换
B. 该电池发生氧化反应的是金属铝
C. 电极的正极反应式为3ClO-+3H2O+6e-=3Cl-+6OH-
D. 当有0.1 mol Al完全溶解时,流经电解液的电子个数为1.806×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C三种物质中均含有同一种元素,它们之间存在如图所示的转化关系(部分反应物已略去). 
请回答下列问题:
(1)若A是一种金属氧化物,B、C均为正盐且B的水溶液呈酸性,C的水溶液呈碱性.请写出反应①和反应④(A可一步转化为B或C)的离子方程式:反应① , 反应④
(2)若反应①为置换反应,反应④为化合反应,C物质大量存在于海水中,是人体生理活动不可缺少的物质.工业上可以用C来制取A或B,请写出这两个反应的化学方程式:C→A;C→B .
(3)若反应①②③均为化合反应,反应④为置换反应.当A为一种金属单质时,请写出反应②和③可能的离子方程式:反应②:;反应③: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象或图象信息不能充分说明相应的化学反应是放热反应的是( )
A. | B. | C. | D. | |
反应 |
|
|
|
|
实验现象 | 温度计的水银柱不断上升 | 反应物总能量大于生成物总能量 | 反应开始后,甲处液面低于乙处液面 | 反应开始后,针筒活塞向右移动 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼( ![]() )可作为火箭发动机的燃料,NH3与NaClO反应可得到肼.
)可作为火箭发动机的燃料,NH3与NaClO反应可得到肼.
(1)实验室用氯化铵和氢氧化钙制备氨气的化学方程式:
(2)已知:①N2(g)+2O2(g)=N2O4(l)△H1=﹣195kJmol﹣1
②N2H4(l)+O2(g)=N2(g)+2H2O(g)△H2=﹣534kJmol﹣1
写出液态肼和N2O4(l)反应生成N2和水蒸气的热化学方程式:
(3)已知断裂1mol化学键所需的能量(kJ)如下:N≡N为942、O=O为498、N﹣N为154、H﹣O为464、请根据N2H4(l)+O2(g)=N2(g)+2H2O(g)△H2=﹣534kJmol﹣1中数据计算断裂1molN﹣H键所需的能量(kJ)是:
(4)写出NH3与NaClO反应得到肼的化学方程式: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com