
分析 (1)依据离子方程式的电荷守恒和原子守恒书写判断产物;
(2)还原剂是元素化合价反应后升高,结合化合价变化分析判断;
(3)依据四个反应分析判断产物.
解答 解:(1)依据离子方程式的电荷守恒和原子守恒书写判断产物,②反应中为2H2O,则方程式为4Fe2++O2+4H+$\frac{\underline{\;微生物\;}}{\;}$ 4Fe3++2H2O;
故答案为:4Fe2++O2+4H+$\frac{\underline{\;微生物\;}}{\;}$ 4Fe3++2H2O;
(2)还原剂是元素化合价反应后升高,反应③中硫元素化合价从-1价变化为0价,所以反应中的还原剂是FeS2;
故答案为:FeS2;
(3)依据①②③④的离子方程式,分析判断最终的生成物为硫酸亚铁和硫酸,
故答案为:FeSO4、H2SO4.
点评 本题考查了氧化还原反应的电荷守恒、原子守恒的应用、氧化还原反应概念的分析判断,题目难度不大,掌握特征变化、分析反应实质、结合概念分析判断,侧重于考查学生的分析能力和应用能力.


科目:高中化学 来源: 题型:解答题
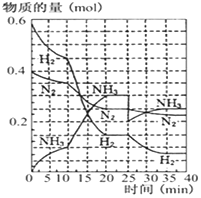 德国人发明了合成氨反应,其原理为:N2(g)+3H2(g)?2NH3(g);已知298K时,△H=-92.4kJ•mol-1,在500℃,20Mpa时,将氮气和氢气通入到体积为2升的密闭容器中,反应过程中各种物质的量变化如右图所示.
德国人发明了合成氨反应,其原理为:N2(g)+3H2(g)?2NH3(g);已知298K时,△H=-92.4kJ•mol-1,在500℃,20Mpa时,将氮气和氢气通入到体积为2升的密闭容器中,反应过程中各种物质的量变化如右图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2项 | B. | 3项 | C. | 4项 | D. | 5项 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
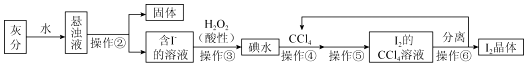
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇、乙酸均能与 Na 反应放出 H2,二者分子中官能团相同 | |
| B. | 乙烯和苯都能与 H2 发生加成反应,说明二者均含有碳碳双键 | |
| C. | 苯可以在空气中燃烧,但不能被酸性高锰酸钾溶液氧化 | |
| D. | 乙醇在铜催化作用下,能发生还原反应生成乙醛 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应Ⅰ是氧化还原反应,反应Ⅱ是非氧化还原反应 | |
| B. | H3PO2具有还原性,在空气中可能被氧化成磷酸 | |
| C. | 反应Ⅰ中氧化剂与还原剂的质量之比为1:1 | |
| D. | 反应Ⅰ中,在标准状况下生成2.24 L PH3时,转移0.3 mol电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com