
海水制取溴:
(1)主要流程:
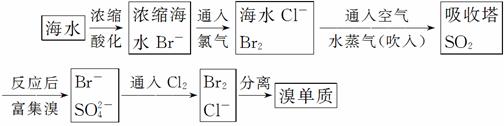
(2)主要反应(化学反应方程式):
__________________________________。
(3)最后分离实验操作是 、
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g) 2C(g)。若经2 s后测得C的浓度为0.6 mol·L-1,现有下列几种说法:①用物质A表示的反应的平均速率为0.3 mol·L-1·s-1 ;②用物质B表示的反应的平均速率为0.6 mol·L
2C(g)。若经2 s后测得C的浓度为0.6 mol·L-1,现有下列几种说法:①用物质A表示的反应的平均速率为0.3 mol·L-1·s-1 ;②用物质B表示的反应的平均速率为0.6 mol·L -1·s-1;③2s时物质C的转化率为30% ;④2 s时物质B的浓度为0.7 mol·L-1。其中正确的是
-1·s-1;③2s时物质C的转化率为30% ;④2 s时物质B的浓度为0.7 mol·L-1。其中正确的是
A.①③ B.①④ C.②③ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
将12mol/L的盐酸(ρ=1.19g/cm3)50mL稀释成6mol/L的盐酸(ρ=1.10g/cm3),需加水的体积为( )
A. 50mL B. 50.5mL C. 55mL D. 59.5mL
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中不正确的是( )
A.食醋中含有乙酸,乙酸可由乙醇氧化得到
B.乙醇、乙酸乙酯、乙酸能用饱和碳酸钠溶液鉴别
C.乙酸、乙酸乙酯、葡萄糖和淀粉的最简式相同
D.生活中食用的食醋、植物油、动物蛋白等都是混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学药品的贮存方法正确的是 ( )
A.新制氯水存放在带玻璃塞的无色细口瓶中
B.镁条保存在细口瓶中密闭保存
C.氢氧化钠固体保存在带橡胶塞的广口瓶中
D.少量金属钠保存在煤油、四氯化碳等有机溶剂中
查看答案和解析>>
科目:高中化学 来源: 题型:
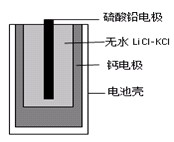
热激活电池可用作火箭、导弹的工作电。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池的总反应方程式为:PbSO4+2LiCl+Ca = CaCl2+Li2SO4+Pb。
下列有关说法正确的是 ( )
A.正极反应式:Ca +2Cl--2e-=CaCl2
B.放电过程中,Li+向负极移动
C.每转移0.1mol电子,理论上生成20.7gPb
D.常温时,在正负极间接上电流表或检流计,指针不偏转
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.(1)现有pH相等、等体积的Ba(OH)2、NaOH和NH3·H2O三种溶液,将它们分别与V1 L、V2 L、V3 L等浓度的盐酸混合恰好中和, 则V1、V2、V3的大小关系是 ;
现有物质的量浓度相等、等体积的Ba(OH)2、NaOH和NH3·H2O三种溶液,将它们分别与V1 L、V2 L、V3 L等浓度的盐酸混合,混合后溶液呈中性,则V1、V2、V3的大小关系是 ;
(2)常温下,将浓度为amol/L的氨水与浓度为bmol/L的盐酸等体积混合,恰好呈中性(溶液体积变化忽略不计),则氨水的电离平衡常数Kb=
(3)氨水和NH4Cl等物质的量混合配制成的稀溶液,c(Cl-)<c(NH4+),下列说法错误的是( )
A、氨水的电离作用大于NH4Cl的水解作用 B、氨水的电离作用小于NH4Cl的水解作用
C、氨水的存在抑制了NH4Cl的水解 D、NH4Cl的存在抑制了氨水的电离
E、 c(H+)>c(OH-) F、 c(NH3•H2O)>c(NH4+)
G、c(NH3•H2O)+c(NH4+)=2c(Cl-) H、c(NH3•H2O)+c(OH-)=c(Cl-)+c(H+)
Ⅱ.某种甲酸酯水解反应方程式为:
HCOOR (l) + H2O(l) HCOOH (l) +ROH (l) △ H > 0
HCOOH (l) +ROH (l) △ H > 0
某小组通过实验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始浓度如下表:
| 组分 | HCOOR | H2O | HCOOH | ROH |
| 物质的量浓度/mol·L一1 | 1.00 | 1. 99 | 0.01 | 0.52 |
甲酸酯转化率在温度T1下随反应时间(t)的变化如下图:.
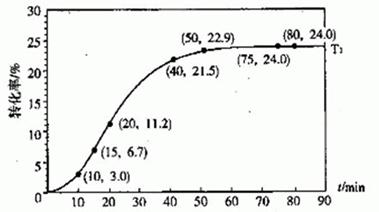
根据上述条件,计算不同时间范围内甲酸酯的平均反应速率,结果见下表:
| 反应时间/min | 0~5 | 10~15 | 20~25 | 30~35 | 40~45 | 50~55 | 75~80 |
| 平均速率/10-3mol·L-1·min-1 | 1.9 | 7.4 | 7.8 | 4.4 | 1.6 | 0.8 | 0.0 |
(1)T1温度下平衡体系中。c(ROH )为________ mol ·L一1
(2)15~20min范围内用甲酸酯表示的平均反应速率为________ mol ·L一1·min一1 ,(不要求写出计算过程)。
(3)根据题给数据分析,从影响反应速率的角度来看,生成物甲酸在该反应中还起到了_________的作用。
查看答案和解析>>
科目:高中化学 来源: 题型:
取34.0g只含羟基,不含其他官能团的液态饱和多元醇,置于50.0L氧气中,经点燃,醇完全燃烧,反应后气体体积减少5.6L,将气体经CaO吸收,体积又减少28.0L(所有气体体积均在标准状况下测定)。
(1)该醇中C、H、O的原子个数比为 ▲
(2)该醇的分子式为 ▲
(3)如果将多元醇的任意一个羟基换成一个卤原子,所得到的卤代物都只有1种,写出该饱和多元醇的结构简式 ▲ 。
(请写出计算过程,无计算过程不得分)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com