
| A、SO2、Cl2、氨水 |
| B、AgCl、Ba(OH)2、HClO |
| C、NaOH、HCl、NaCl |
| D、酒精、Cu、蔗糖 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、气体A为二氧化硫和氢气的混合物 |
| B、气体A中二氧化硫和氢气的体积比为4:1 |
| C、反应中共消耗锌95.5g |
| D、反应中共转移电子1.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
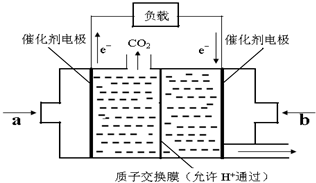 随着世界工业经济的发展、人口的剧增,全球能源紧张面临着越来越严重的问题,煤经过化学加工可转化为气体或液体以及各种化工产品,从而提高了煤的利用率.
随着世界工业经济的发展、人口的剧增,全球能源紧张面临着越来越严重的问题,煤经过化学加工可转化为气体或液体以及各种化工产品,从而提高了煤的利用率.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
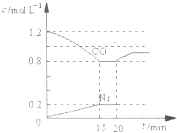 已知B是一种由三种短周期(各位于不同周期)元素组成的正盐,该盐在常用锌锰干电池中做电解质:Y在常温下为液态,E的相同对分子质量比D大16,它们存在如下转化关系(反应条件及部分产物已略去);
已知B是一种由三种短周期(各位于不同周期)元素组成的正盐,该盐在常用锌锰干电池中做电解质:Y在常温下为液态,E的相同对分子质量比D大16,它们存在如下转化关系(反应条件及部分产物已略去);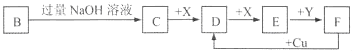
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若X、Y、W形成的化合物为XYW2,则其水溶液可以显碱性 |
| B、Y的最高价氧化物对应的水化物一定是碱 |
| C、稳定性:W的氢化物>Z的氢化物,沸点:Z的氢化物>W的氢化物 |
| D、X、Y的氧化物晶体类型一定相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向等浓度且较稀的NaCl,KI混合液中滴加AgNO3溶液 | 先出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| B | 向溶液X中滴加浓NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸变蓝 | 原溶液中有NH4+ |
| C | 溴乙烷与NaOH溶液共热后,加入AgNO3溶液 | 未出现淡黄色沉淀 | 溴乙烷没有发生水解 |
| D | 将SO2通入溴水中 | 溴水褪色 | SO2具有还原性 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、煤、石油、天然气均为化石能源 |
| B、化石能源是可再生能源 |
| C、直接燃烧煤不如将煤进行深加工后再燃烧效果好 |
| D、化石燃料在燃烧过程中能产生污染环境的SO2等有害气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl2、SO2、NH3的水溶液都能够导电,因此都属于电解质 |
| B、100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显碱性 |
| C、Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小 |
| D、在CuSO4溶液中加入PbS,可转变为铜蓝(CuS),则Ksp(PbS)<Ksp(CuS) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com