
乙二酸(H2C2O4)俗称草酸,是一种重要的化工原料。查阅资料,了解到以下有关信息:
①乙二酸易溶于水,加热至100℃开始升华,125℃时迅速升华,157℃时大量升华并开始分解。乙二酸受热分解生成水、二氧化碳和一种常见的还原性气体。
②乙二酸的钙盐——乙二酸钙为不溶于水的白色晶体。
(1)请写出乙二酸受热分解的化学方程式______________________。
(2)化学兴趣小组的同学用实验证明乙二酸晶体受热分解生成的气体成分。他们利用下图提供的装置,自选试剂,提出了下列实验方案:按A→B→C→C→C→D→E顺序从左至右连接装置,检验乙二酸晶体受热分解生成的气体成分。

请你按整套装置从左至右的顺序填写下表中的空格:
| 仪器符号 | 仪器中所加物质 | 装置作用 |
| B | ||
| C | ||
| C | 氢氧化钠浓溶液 | |
| C | ||
| D | ||
| E |
(3)上述实验中能说明乙二酸受热分解生成了还原性气体的实验现象是________________________________________________________________。
(4)检验乙二酸具有较强的还原性,通常选用的试剂是_______________。
【解析】 (2)根据分解方程式可知,需要检验H2O、CO和CO2三种气体,防止其他装置中水溶液的干扰,则应先检验H2O,装置D中为氧化铜,用来检验CO,CO还原氧化铜生成铜和CO2,防止生成的CO2对原CO2的干扰,则接着检验CO2,最后检验CO;(4)将乙二酸与强氧化性溶液反应,如酸性高锰酸钾溶液,若褪色,则证明乙二酸具有较强的还原性。
【答案】 (1)H2C2O4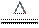
 H2O+CO↑+CO2↑
H2O+CO↑+CO2↑
(2)
| 仪器符号 | 仪器中所加物质 | 装置作用 |
| B | 检验 H2O(g);冷却凝固乙二酸蒸汽,防止其进入C装置影响 CO2的检验。 | |
| C | 澄清石灰水 | 检验 CO2 |
| C | 吸收多余的 CO2 | |
| C | 浓硫酸 | 吸收水蒸气 |
| D | CuO或Fe2O3 | 检验CO |
| E | 处理CO尾气,防止污染空气 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
在恒容密闭容器中发生反应2SO2+O2  2 SO3,当其他条件不变时,只改变一个条件,将生成SO3的反应速率的变化填入下表格里(填“增大”、“减小”或“不变”)。
2 SO3,当其他条件不变时,只改变一个条件,将生成SO3的反应速率的变化填入下表格里(填“增大”、“减小”或“不变”)。
| 编号 | 改变的条件 | 生成的SO3的速率 |
| (1) | 升高温度 | |
| (2) | 充入一定量N2 | |
| (3) | 减少SO3的浓度 | |
| (4) | 使用催化剂 | |
| (5) | 压缩体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数,下列叙述正确的是( )
A.64 g SO2含有氧原子数为1NA
B.物质的量浓度为0.5 mol·L-1的MgCl2溶液,含有Cl-数为1 NA
C.标准状况下,22.4 L H2O的分子数为1NA
D.常温常压下,14 g N2含有分子数为0.5 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.化学反应中化学能只能转化为热能
B.可逆反应达到平衡后,正、逆反应速率均为0
C.N2和H2反应达到平衡后,无N2或H2剩余
D.化学反应中一定有化学键的断裂和生成
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对Ⅰ~Ⅳ实验的现象预测正确的是

A.实验Ⅰ:振荡后静置,液体分层,下层液体无色
B.实验Ⅱ:滴入氢氧化钠溶液后,试管中出现白色沉淀迅速变为灰绿色最后变为红褐色
C.实验Ⅲ:一段时间后,饱和CuSO4溶液中出现蓝色晶体
D.实验Ⅳ:加热后,水槽中先生成白色沉淀,后逐渐溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
化合物A(H3BNH3)是一种潜在的储氢材料,可由六元环状物质(HB===(NH3通过如下反应制得:3CH4+2HB===NH)3+6H2O===3CO2+6H3BNH3。对合成A反应方程式的讨论中不正确的是( )
A.反应前后碳原子的杂化类型不变
B.键角的大小关系:CO2>CH4>H2O
C.第一电离能大小关系:N>O>C>B>H
D.生成物H3BNH3中存在配位键
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大。第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素。D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满。请回答下列问题:
(1)A、B、C的第一电离能由小到大的顺序是________________________(用对应的元素符号表示);基态D原子的电子排布式为
______________________________________________________________。
(2)A的最高价氧化物对应的水化物分子中,其中心原子采取________杂化;BC 的空间构型为________(用文字描述)。
的空间构型为________(用文字描述)。
(3)1 mol AB-中含有的π键个数为________。
(4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图,则该合金中Ca和D的原子个数比是________。

(5)镧镍合金与上述合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力。已知镧镍合金LaNin晶胞体积为9.0×10-23cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=________(填数值);氢在合金中的密度为________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是:
A.实验室用大理石与醋酸反应制取二氧化碳:CaCO3+2H+=Ca2++CO2↑+H2O
B.氯乙酸与氢氧化钠溶液共热: CH2ClCOOH+OH- →CH2ClCOO-+H2O
C.苯酚钠溶液中通入少量二氧化碳: 2C6H5O-+CO2+H2O → 2C6H5OH+CO
D.用银氨溶液检验乙醛中的醛基:
CH3CHO +2Ag(NH3)2+ + 2OH- CH3COO- + NH4+ +3NH3 + 2Ag↓+ H2O
CH3COO- + NH4+ +3NH3 + 2Ag↓+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于化学反应能量变化的说法中正确的是( )
A.凡需要加热的化学反应一定是吸热反应
B.酸碱中和反应,燃烧反应一定是放热反应
C.使用催化剂的化学反应一定是吸热反应
D.氧化还原反应和化合反应一定是放热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com