

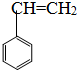
 ;②CH3-CH=CH-CH3; ③CH2=CH-CH=CH2;④CH≡C-CH3;⑤
;②CH3-CH=CH-CH3; ③CH2=CH-CH=CH2;④CH≡C-CH3;⑤
| A、①② | B、④⑤ | C、③⑤ | D、①③ |
 ,在将双键中的1个c-c打开,然后将半键闭合即可的该高聚物单体是CH2=CH-CH=CH2、
,在将双键中的1个c-c打开,然后将半键闭合即可的该高聚物单体是CH2=CH-CH=CH2、 .
.

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯气与NaOH溶液反应:Cl2+OH-=Cl-+ClO-+H2O |
| B、碳酸钙溶于醋酸溶液中:CaCO3+2H+=Ca2++H2O+CO2↑ |
| C、氧化镁与稀硫酸溶液反应:MgO+2H+=Mg2++H2O |
| D、钠与水反应:Na+H2O=Na++H2↑+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使甲基橙变红的溶液:Fe2+、K+、SO42-、NO3- |
| B、加入铝粉产生氢气的溶液:Na+、K+、SO42-、Cl- |
| C、0.1 mol?L-1NaAlO2溶液:Al3+、Na+、Cl-、NO3- |
| D、水电离出的c(H+)=10-12 mol?L-1的溶液:Na+、K+、NH4+、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,2.24LH2O含有的分子数等于0.1NA |
| B、20g重水(D2 O)所含的电子数为10NA |
| C、标准状况下,2.24LCl2与过量的稀NaOH 溶液反应,转移电子总数为0.2NA |
| D、25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 |
B、 |
C、 |
D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com