
【题目】用酸性氢氧燃料电池为电源进行电解的实验装置示意图如下图所示。下列说法中,正确的是( )
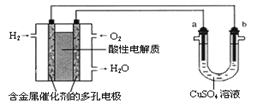
A. 燃料电池工作时,正极反应为:O2 + 2H2O + 4e-= 4OH-
B. a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出
C. a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
D. a、b两极均是石墨时,在相同条件下a极产生的气体与电池中消耗的H2体积相等
【答案】C
【解析】试题分析:A.在燃料电池工作时,通入氧气的电极为正极,由于电解质溶液为酸性,所以正极反应为:O2+4H++4e-=2H2O,错误;B. a极是铁,与电源的正极连接,是阳极,属于活性电极,发生反应:Fe-2e-=Fe2+;b极是铜,与电源的负极连接为阴极,发生反应:Cu2++2e-=Cu,所以a极逐渐溶解,b极质量增加,错误;C. a极是粗铜,b极是纯铜时,a极发生的电极反应是:Cu-2e-=Cu2+;逐渐溶解,b极上发生的电极反应是:Cu2++2e-=Cu,有铜析出,正确。a、b两极均是石墨时,在相同条件下,a极发生反应:4OH--4e-=2H2O+O2↑,电池的负极发生的反应是:2H2-4e-=4H+,根据在闭合回路中电子转移数目相等可知,a极产生的气体是电池中消耗的H2体积的一半,错误。


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】已知25℃时,Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=5.0×10-13。该温度下,下列说法错误的是
A. AgCl的悬浊液中通入少量HCl,c(Ag+)减小
B. AgCl和AgBr共存的悬浊液中,c(Cl-)/c(Br-)=360
C. AgBr悬浊液中加入足量NaCl可能有AgCl沉淀生成
D. 等浓度的NaCl和NaBr混合溶液中滴加AgNO3溶液,先析出AgCl沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,既属于氧化还原反应同时又是吸热反应的是
A.灼热的炭与CO2反应B.甲烷与O2的燃烧反应
C.铝与稀盐酸D.Ba(OH)2·8H2O与NH4Cl反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬是人体必需元素,如含量不足会影响糖类和脂类的代谢,过高则会引起急性中毒。工业上往往采取下列循环工艺防止铬的污染:

完成下列填空:
(1)含Cr2O72-离子的废水在酸性条件下用Fe3O4处理,反应的离子方程式如下,配平该离子反应方程式:
_____Cr2O72-+Fe3O4+H+→Cr3++Fe3++H2O
(2)工业上处理含Cr2O72-的废水时,一般将剧毒的Cr2O72-转化为Cr3+,以碳为阴极,铁作阳极,电解处理含NaCl、Cr2O72-的酸性废水。写出电极反应:阳极_____________________ 阴极_______________________;用铁做阳极的目的是:_____________________
(3)反应⑤是可逆反应,在Na2CrO4溶液中加入稀硫酸,溶液由黄色逐渐变成橙色,写出该反应的离子方程式:______________________
(4)已知Ag2CrO4和AgCl的Ksp分别为9.0×10-12、1.56×10-10,向含有相同浓度的Na2CrO4和NaCl的混合溶液中逐滴加入硝酸银溶液,首先生成的沉淀是__________
(5)向上述反应后的溶液中加入碱溶液,让废水的pH升至8~10,控制适当的温度,使产物中的金属阳离子全部转变为沉淀。回收所得的Cr(OH)3,经处理后又可转变成K2Cr2O7。纯净的K2Cr2O7常用于准确测定Na2S2O3溶液的物质的量浓度,方法如下:① Cr2O72- +6I- + 14H+ →3I2 + 2Cr3+ + 7H2O ② 2S2O32- + I2→S4O62- + 2I- ,准确称取纯净的K2Cr2O7 0.294g ,配成溶液,用Na2S2O3溶液滴定,消耗Na2S2O3溶液25.00mL。则Na2S2O3溶液的物质的量浓度为_____________________(保留四位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
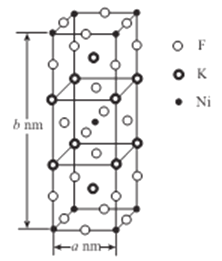
【题目】
K、Fe、Ni均为重要的合金材料,在工业生产、科技、国防领域有着广泛的用途,请回答下列问题:
(1)K元素处于元素周期表的_____ 区,其基态原子中,核外电子占据的电子云轮廓图为球形的能级有______个。
(2)KCl 和NaCl 均为重要的化学试剂,KCl 的熔点低于NaCl的原因为___________。
(3)从原子结构角度分析,Fe3+比Fe2+更稳定的原因是__________。
(4)NiSO4 溶于氨水形成[Ni (NH3)6]SO4。
①写出一种与[Ni(NH3)6]SO4中的阴离子互为等电子体的分子的分子式_________。
②1mol[Ni(NH3)6]SO4中含有σ键的数目为___________。
③NH3 的VSEPR模型为_____ ;中心原子的杂化形式为_____,其杂化轨道的作用为__________。
(5)K、Ni、F三种元素组成的一种晶体的长方体晶胞结构如图所示。若NA为阿伏加德罗常数的值,该晶体的密度ρ=______g/cm3(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金刚石和石墨均为碳的同素异形体,氧气不足时它们燃烧生成一氧化碳,充分燃烧时生成二氧化碳,反应中放出的热量如图所示。

(1)写出石墨转化为金刚石的热化学方程式____________________________________。
(2)写出石墨和二氧化碳反应生成一氧化碳的热化学方程式_____________________。
(3)科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:
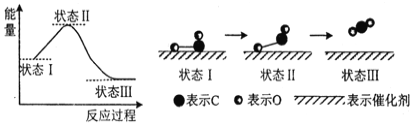
①判断CO和O生成CO2是放热反应的依据是__________________。
②写出CO2的电子式___________________,CO2含有的化学键类型是(若含共价键,请标明极性或非极性)______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知C6H14有多种同分异构体,则其同分异构体中沸点最高的分子的一氯取代物的种数(不考虑立体异构)是( )
A. 2 B. 3 C. 4 D. 5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学-选修3:物质结构与性质】磷是人体含量较多的元素之一,磷的化合物在药物生产和农药制造等方面用途非常广泛。回答下列问题:
(1)基态磷原子核外共有________个未成对的电子。
(2)P4S3可用于制造火柴,其结构如图所示。

①电负性:磷_______硫;第一电离能:磷_______硫; (填“>”或“<)。
②P4S3中硫原子的杂化轨道类型为_______。
(3)N、P、As、Sb均是第VA族的元素。
①上述元素的氢化物的沸点关系如图乙所示,沸点:PH33,原因是_______;沸点:PH333,原因是_______。
②某种磁性氮化铁的晶胞结构如图丙所示,该化合物的化学式为_______。
(4)磷化铝熔点为2000℃,它与晶体硅互为等电子体,磷化铝晶胞结构如图丁所示。
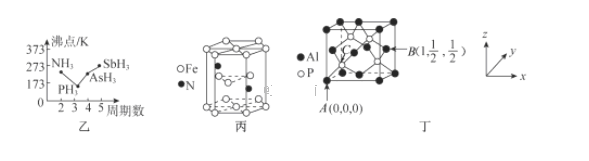
①图中A点和B点的原子坐标参数如图丁所示,则C点的原子坐标参数为_______。
②磷化铝晶体的密度为ρg·cm-3用NA表示阿伏加德罗常数的数值,则该晶胞中距离最近的两个铝原子之间的距离为_______cm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com