
下列有关物质性质的应用正确的是( )
A.液氨汽化时要吸收大量的热,可用作制冷剂
B.二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸
C.生石灰能与水反应,可用来干燥氯气
D. 从海水中提取物质都必须通过化学反应才能实现
科目:高中化学 来源: 题型:
核磁共振氢谱是指有机物分子中的氢原子核所处的化学环境(即其附近的基团)不同,表现出的核磁性就不同,代表核磁性特征的峰在核磁共振图中坐标的位置(化学位移,符号为δ)也就不同。现有一物质的核磁共振氢谱如图所示:

则该物质可能是下列中的( )
A.CH3CH2CH3 B.CH3CH2CH2OH C.CH3CH2CH2CH3 D.CH3CH2CHO
查看答案和解析>>
科目:高中化学 来源: 题型:
[化学——选修3:物质结构与性质](15分)
已知:A、B、C、D为周期表1~36号中的元素,它们的原子序数逐渐增大。A的基态原子有3个不同的能级,各能级中电子数相等;C的基态原子2p能级上的未成对电子数与A原子相同;D的基态原子的M电子层上有4个未成对电子。
请回答下列问题:
(1)D是元素周期表中第________周期,第________族的元素;其基态原子的外围电子排布式为________。
(2)A、B、C、D四种元素中,电负性最大的是________(填元素符号)。
(3)由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-中A原子的杂化方式为________。B的氢化物的沸点远高于A的氢化物的沸点的主要原因是_____________________________________________________________
_____________________________________________________________。
(4)D能与AC分子形成D(AC)5,其原因是AC分子中含有________________。D(AC)5常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断D(AC)5晶体属于________(填晶体类型)。
(5)SiO2的晶胞可作如下推导:先将NaCl晶胞中的所有Cl-去掉,并将Na+全部换成Si原子,再在每两个不共面的“小立方体”中心处各放置一个Si原子便构成了晶体Si的一个晶胞。再在每两个相邻的Si原子(距离最近的两个Si原子)中心连线的中点处增添一个O原子,便构成了SiO2晶胞,故SiO2晶胞中有________个Si原子,________个O原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
我国支持“人文奥运”,坚决反对运动员服用兴奋剂。某种兴奋剂的结构简式如右图所示,有关该物质的说法正确的是 ( )
A.遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物
 B.滴入KMnO4(H+)溶液,观察紫色褪去,
B.滴入KMnO4(H+)溶液,观察紫色褪去,
能证明结构中存在碳碳双键
C.该分子中的所有原子有可能共平面
D.1 mol该物质与浓溴水和H2反应最多
消耗Br2和H2分别为4 mol、7 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
 溴乙烷在不同溶剂中与NaOH可发生不同类型的反应,生成不同的反应产物。某同学依据溴乙烷的性质,用右图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究。
溴乙烷在不同溶剂中与NaOH可发生不同类型的反应,生成不同的反应产物。某同学依据溴乙烷的性质,用右图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究。
实验操作Ⅰ:在试管中加入5 mL 1 mol/L NaOH水溶液和5 mL 溴乙烷,将试管如图固定后,加热。
(1)请写出该反应的化学方程式 。
(2)观察到 现象时,表明溴乙烷与NaOH溶液已完全反应。
(3)欲将生成的乙醇从反应混合物中进行分离出来,最简单的操作是
(4)请简述如何检验溴乙烷中含有溴元素
实验操作II:在试管中加入5 mL NaOH乙醇溶液和5 mL 溴乙烷,将试管如图固定后,加热。
(5)请写出该反应的化学方程式 。
(6)为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,在你设计的实验方案中,需要检验的是 ,检验的方法是
(需说明:所用的试剂、简单的实验操作及预测产生的实验现象)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列几种情况都有白色沉淀物质生成,其中生成物化学成分相同的是 ( )
①块状纯碱久置于空气中生成的白色粉末
②盛澄清石灰水的烧杯内壁附着的白色物质
③生石灰久置于空气中生成的白色物质
④Na2SiO3水溶液置于敞口容器中,溶液中出现的白色浑浊物
A.①④ B.②③ C.①② D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n。已知,最简单的氢铝化合物的分子式为Al2H6,它的熔点为150℃,燃烧热极高。Al2H6球棍模型如下图。下列有关说法不正确的是
A.Al2H6在固态时所形成的晶体是分子晶体
B.氢铝化合物可能成为未来的储氢材料和火箭燃料
C.Al2H6中含有离子键和极性共价键
D.Al2H6在空气中完全燃烧,产物为氧化铝和水

查看答案和解析>>
科目:高中化学 来源: 题型:
氨气是中学化学中常见的气体,其用途广泛。
(1)实验室制取氨气的化学方程式是 。
 (2)工业上氨气可以由氢气和氮气合成。
(2)工业上氨气可以由氢气和氮气合成。
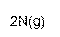


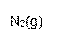
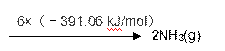
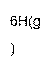
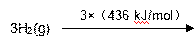

① 该反应的热化学方程式是 。
② 随着温度的升高,该反应的化学平衡常数的变化趋势是 。
③ 一定温度下,2 L密闭容器中,5 molN2和5 molH2发生反应,达到平衡时,N2的转化率为20%,该温度下反应的平衡常数的数值是 。
④ 简述一种检查氨气是否泄露可采用的化学方法: 。
(3)工业制硫酸的尾气中含较多的SO2,为防止污染空气,回收利用SO2,工业上常用氨水吸收法处理尾气。
① 写出氨水吸收SO2 的化学反应方程式 。
② (NH4)2SO3显碱性,用化学用语和必要的文字解释其原因 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com