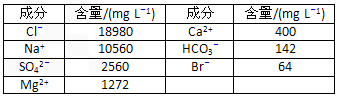
(三选一)【选修2:化学与技术】
随着信息产业的高速发展和家用电器的普及,我国印刷电路板(PCB)的生产呈现急剧增长之势。废旧电路板的增多给我们带来了环境问题,目前我们大多采用32%~35%的FeCl3溶液溶解印刷线路板上的金属铜,从而进行对铜的回收和利用。经分析腐蚀废液中主要含有HCl、FeCl2和CuCl2等溶质。
(1)用32%~35%的FeCl3溶液溶解印刷线路板上的金属铜的原理是(用离子方程式表示)_____________________。
(2)工业上有多种回收腐蚀废液中铜的方法,下面是常用的两种方法。
方法一:电化学方法回收腐蚀废液中的铜,则阳极(石墨)上的电极反应式为_______________。
方法二:工业上也可以用铁粉回收腐蚀废液中的铜。
①用铁粉回收铜的实验操作为___________。
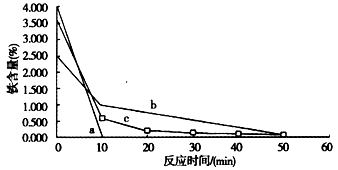
②科学家对铁置换铜工艺的研究如下:分别用还原铁粉、废铁屑和废铁屑在超声波粉碎处理下置换铜,将置换出的铜粉放入250mL烧杯中,加入 120mL1.5mol/L的硫酸,水浴加热,控制温度在70℃,搅拌,在10min、20min、30min、40min、50min、 60min时,分别用吸管移取0.5g左右的铜于试管内,将上层清液倒回小烧杯中,用蒸馏水洗净试样,过滤,在 105℃烘箱中烘干后测定铜粉中铁的含量。其结果如图所示。
已知a表示用还原铁粉置换铜的除铁效果,b表示用废铁屑置换铜的除铁效果,c表示用废铁屑在超声波下置换铜的除铁效果,你认为除铁效果最好的是_______(填a、b或c),其原因是______________________。

 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案