
| A. | Cl-的半径比Cl的半径小 | |
| B. | Cl2和Cl-都有毒性 | |
| C. | Cl-和Cl2都呈黄绿色 | |
| D. | Cl、HClO、Cl2及Cl-中,Cl的化学活动性最强 |
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 物质 | 除杂试剂 | 分离方法或操作 |
| A | 乙醇(水) | 无水CuSO4 | 充分反应后蒸馏 |
| B | 苯(Br2) | NaOH溶液 | 振荡静置后过滤 |
| C | NaCl固体(KNO3) | 水 | 高温溶解、降温结晶 |
| D | BaCO3(BaSO4) | 饱和Na2CO3溶液 | 充分浸泡后过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 价电子排布为4s24p2的元素位于第四周期第ⅤA族,是P区元素 | |
| B. | 1,2-二甲苯核磁共振氢谱中有三组峰,且氢原子数之比为3:1:1 | |
| C. | 钠原子由1s22s22p63s1→1s22s22p63p1时,原子释放能量,由基态转化成激发态 | |
| D. | 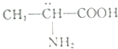 分子属于手性分子 分子属于手性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | E、B、A、D、C | B. | D、B、C、A、E | C. | E、C、D、B、A | D. | A、B、C、D、E |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.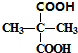 +2C2H5OH$→_{△}^{浓硫酸}$
+2C2H5OH$→_{△}^{浓硫酸}$ +2H2O.
+2H2O. 与足量NaOH水溶液反应的化学方程式为
与足量NaOH水溶液反应的化学方程式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 仪器标号 | 仪器中所加物质 | 作用 |
| A | 亚硫酸钠、浓硫酸 | 产生SO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com