
为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和下图所示的实验装置进行实验。请回答下列有关问题: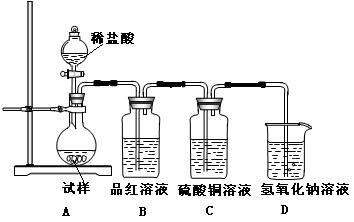
(1)若某种固体物质受热发生了分解,下列说法正确的是( )
A.充分加热后一定有固体残留 B.加热前后固体颜色一定无变化
C.加热前后固体质量一定有变化 D.一定生成了新的物质
E.充分加热后得到的残留固体一定为混合物
(2)查阅资料:无水亚硫酸钠隔绝空气受热到600℃才开始分解,且分解产物只有硫化钠和另外一种固体,则Na2SO3固体加热到600℃以上分解的化学方程式 。如果加热温度低于600℃,向所得固体试样中缓缓滴加稀盐酸至足量,在滴加稀盐酸的整个过程中HSO3—的物质的量浓度变化趋势为 ;
(3)如果加热温度高于600℃一段时间后,向所得固体试样中缓缓滴加稀盐酸至足量,观察到烧瓶中出现淡黄色沉淀,且有大量气泡产生,则固体试样跟盐酸反应生成淡黄色沉淀的离子方程式为 ;此时在B、C两装置中可能观察到得现象为 。
(4)在(3)中滴加足量盐酸后,烧瓶内除Cl-外,还存在另一种浓度较大的阴离子(X)。为检验该阴离子(X),先取固体试样溶于水配成溶液,以下是检验阴离子(X)的两种实验方案,你认为合理的方案是 (填“甲”或“乙”),请说明另一方案不合理的原因 。
方案甲:取少量试样溶液于试管中,先加稀HNO3,再加BaCl2溶液,有白色沉淀生成,证明该离子存在。
方案乙:取少量试样溶液于试管中,先加稀HCl,再加BaCl2溶液,有白色沉淀生成,证明该离子存在。
(1)D(2分)
(2)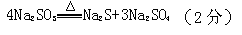 ,先逐渐增大,后逐渐减小(2分)
,先逐渐增大,后逐渐减小(2分)
(3)2S2-+SO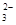 +6H+ =3S↓+3H2O(2分); B中品红溶液褪色,C中无明显变化(或答“B中无明显变化,C中产生黑色沉淀”, 答“B中品红溶液褪色,C中产生黑色沉淀”不得分) (2分)
+6H+ =3S↓+3H2O(2分); B中品红溶液褪色,C中无明显变化(或答“B中无明显变化,C中产生黑色沉淀”, 答“B中品红溶液褪色,C中产生黑色沉淀”不得分) (2分)
(4)乙(2分);甲中先加入具有强氧化性的稀HNO3,它能将SO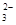 氧化成SO
氧化成SO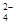 ,不能判定是否生成SO
,不能判定是否生成SO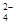 (2分)
(2分)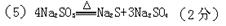 (2分)
(2分)
解析试题分析:(1)A.充分加热后不一定有固体残留,如碳酸氢铵分解,故A不符合; B.加热前后固体颜色不一定无变化,如高锰酸钾溶液前后有元素变化,故B不符合;C.加热前后固体质量不一定有变化,如亚硫酸钠受热分解生成硫化钠和硫酸钠,因分解产物都是固体,因此反应前后固体质量并没有发生变化,故C不符合; D.一定生成了新的物质,化学反应一定有新物质变化,故D符合;E.充分加热后得到的残留固体不一定为混合物,如氯酸钾完全分解生成氯化钾和氧气,故E不符合;故选D; (2)由题意,Na2SO3要加热到600度以上才分解,因此题中加热温度600度以下冷却后得到的固体仍为Na2SO3向此固体中滴加HCl后,一方面是Na2SO3固体溶于水,这将导致溶液中SO32-浓度增大;另一方面是HCl与SO32-反应,这将导致SO32-浓度减小生成亚硫酸氢根离子浓度增大;加入HCl到一定程度时,SO32-已完全转化为HSO3-,此时前者作用消失,完全是后者起作用,HSO3-浓度先增大后将逐渐减小,直至最后下降到接近于零,故答案为:先逐渐增大,后逐渐减小;(3)如果加热温度为700℃,向所得固体试样中缓缓滴加稀盐酸至足量,观察到烧瓶中出现淡黄色沉淀为硫,且有大量气泡产生说明为二氧化硫,则固体试样跟盐酸反应生成淡黄色沉淀的离子方程式为:2S2-+SO32-+6H+=3S↓+3H2O;生成二氧化硫的反应为SO32-+2H+=SO2↑+H2O,此时在B、C两装置中可能观察到得现象为二氧化硫具有漂白作用使品红褪色,生成的气体不是硫化氢通过硫酸铜无现象;(4)在(3)中滴加足量盐酸后,烧瓶内除Cl-外,还存在另一种浓度较大的阴离子(X).通过实验分析判断,离子为硫酸根离子,确定分解产物为硫化钠和硫酸钠,为检验该阴离子(X),先取固体试样溶于水配成溶液,为了加速固体试样的溶解,可以用玻璃棒搅拌或加热,检验硫酸根离子是加入盐酸,无变化,再加入氯化钡生成白色沉淀证明是硫酸根离子;甲实验加硝酸,原来溶液中含亚硫酸钠,遇硝酸被氧化为硫酸钠,干扰硫酸根离子的检验,故答案为:搅拌(或加热); 乙;甲中先加入具有强氧化性的稀HNO3,它能将SO32-氧化成SO32-,不能判定是否生成SO32-;(5)依据上述分析判断,亚硫酸钠加热到600℃以上分解生成硫化钠和硫酸钠,反应的化学方程式为4Na2SO3=Na2S+3Na2SO4。
考点:本题考查了物质性质验证的实验设计和实验分析判断,主要考查硫及其化合物性质的应用,题目难度中等。


科目:高中化学 来源: 题型:实验题
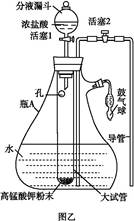
氯水是实验室常需临时配制的一种试剂。图甲所示的是实验室配制氯水时的一种常用装置,图乙是某化学实验小组自行设计的一种配制氯水的装置(图中的鼓气球是一种具有气体单向阀的可用于向瓶中鼓入空气的仪器)。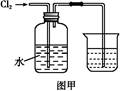
(1)氯水需临时配制的原因是 (用化学方程式表示)。
(2)图甲所示装置中,烧杯内的液体是 。
(3)用图乙所示装置中配制氯水时,操作步骤如下:
①关闭活塞2 ,打开分液漏斗上口的玻璃塞,再打开活塞1 ,将少量浓盐酸注入大试管内。
②关闭活塞1 ,盖上分液漏斗上口玻璃塞。浓盐酸和大试管内的高锰酸钾粉末反应产生氯气。
③轻轻摇动瓶A ,使氯气不断溶入水中。用图乙装置能在较短时间内得到饱和氯水。除了在摇动过程中增大了气体和水的接触面以外,另一个重要原因是 。
分液漏斗中的浓盐酸应分数次加入试管内。若一次加入太多的浓盐酸,可能引起的后果是 。
(4)配制氯水完成后,不必拆卸装置即可从瓶A 中取用少量氯水,方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某研究性学习小组按下图所示装置进行探究实验。
请回答下列问题:
(1)装置A中发生反应的化学方程式为 。
(2)实验过程中,装置B发生的现象是 ,发生反应的离子方程式为 。
(3)装置C中发生的现象是 ,这说明SO2具有的性质是 。
(4)装置D的目的是探究SO2与品红作用的稳定性,请写出实验操作及现象
。
(5)试设计实验验证装置B溶液是否含有SO42- 。
(6)试在框图内画出SO2尾气处理装置图。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某小组设计如图装置(部分夹持装置已略去),以探究潮湿的Cl2与Na2CO3反应得到固体物质的成分。
(1)A中制取Cl2的离子方
程式__________________
(2)通入一定量潮湿的Cl2反应后,经检测,D中只有Cl2O一种气体,C中只含一种氯盐外,同时含有NaHCO3等,某同学对C中所得固体残渣的成分进行探究。
①提出合理假设。
假设1:存在两种成分:NaHCO3和_____________________________;
假设2:存在三种成分:NaHCO3和_____________________________。
②设计方案,进行实验。写出实验步骤以及预期现象和结论。
限选实验试剂和仪器:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
| 实验步骤 | 预期现象和结论 |
| 步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中. | |
| 步骤2: 向A试管中滴加BaCl2溶液 | |
| 步骤3: | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。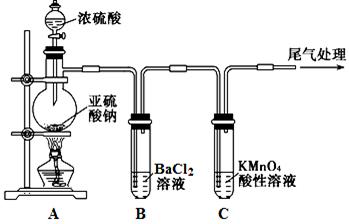
已知:Na2SO3+H2SO4(浓)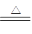 Na2SO4+SO2↑+H2O
Na2SO4+SO2↑+H2O
请回答下列问题:
(1)装置A中盛放浓硫酸的仪器名称是 。
(2)实验过程中,C中的现象是 ,说明SO2具有 性。
(3)实验过程中,观察到装置B中出现了明显的白色沉淀。为探究该白色沉淀的成分,该小组同学进行了如下实验: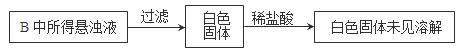
根据实验事实判断该白色沉淀的成分是 (填化学式),产生该白色沉淀的原因可能是 (填字母编号)。
a.BaSO3既不溶于水也不溶于酸
b.BaCl2溶液中可能溶解有氧气
c.BaCl2溶液中可能混有NaOH
d.由A制得的SO2气体中可能混有氧气
(4)如果将装置A中的浓H2SO4换作浓HNO3,对此实验是否有影响并明理由 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中 有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如下图所示的实验装置(支撑用的铁架台省略),完成下列问题。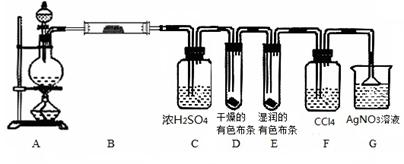
(1)用 MnO2和浓盐酸混合共热制得氯气的化学方程式是____ ____。
(2)若用含有0.2 mol HCl的浓盐酸与足量的MnO2反应制Cl2,制得的Cl2体积在标准状况下总是小于1.12 L的原因是_____________________________________________。
(3)①装置B的作用是____________________________________________________,
装置B中的现象是____________________________。
②装置D和E出现的不同现象说明的问题是_____________________________。
③装置F的作用是________________________。
④装置G中发生反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某同学拟定了以下实验方案,来确定一批合金废料的成分并加以回收利用。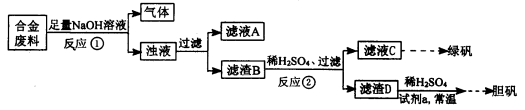
请回答下列问题:
(1)从上述信息可确定该合金中一定含有Fe和____(填化学式)。
(2)“试剂a”是一种不引入杂质的绿色氧化剂,该氧化剂的化学式为____;滤渣D、稀硫酸和试剂a总反应的化学方程式为 。
(3)若反应①产生的气体是H2,则验证滤液A只含NaAlO2、不含Na2SiO3的方法是:取少量滤液A于试管中,滴加 。
Na2SiO3溶液与过量的CO2反应的离子方程式为 。
(4)取质量均为13.2g的滤渣B四份,分别加入相同浓度,不同体积的稀HNO3充分反应,标准状况下所生成的NO(设还原产物只有一种)体积与剩余固体金属的质量如下表:
| 实验编号 | ① | ② | ③ | ④ |
| 稀HNO3体积(mL) | 100 | 200 | 300 | 400 |
| 剩余金属质量(g) | 9.0 | 4.8 | 0 | 0 |
| NO体积(L,标况) | 1.12 | 2.24 | 3.36 | 4.48 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。
请回答下列问题: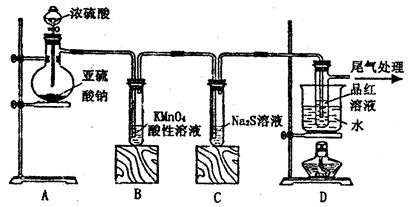
(1)装置A中盛放亚硫酸钠的仪器名称是___________,其中发生反应的化学方程式为_____________________________________________;
(2)实验过程中,装置B、C中发生的现象分别是___________、_____________,这些现象分别说明SO2具有的性质是_________和___________;配平下面离子方程式:
□SO2+□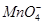 +□H2O=□
+□H2O=□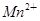 +□
+□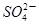 +□H+;
+□H+;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象______________________;
(4)尾气可采用____________________溶液吸收。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某化学课外活动小组通过实验研究NO2的性质。
已知:2NO2+2NaOH=NaNO3+NaNO2+H2O
利用下图1所示装置探究NO2能否被NH3还原(K1,K2为止水夹.夹持固定装置略去)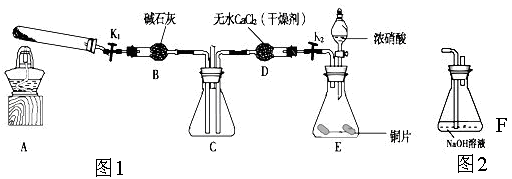
(1)E装置中制取NO2反应的离子方程式是 。
(2)该实验中制取氨气时若只用一种试剂,从下列物质中选取 。
a.NH4HCO3 b.NH4Cl c.浓氨水
(3)若NO2能够被NH3还原,预期观察到C装置中的现象是 。
(4)实验过程中气密性良好,但未能观察到C装置中的预期现象。该小组同学分析其原因可能是:
①;还原性较弱,不能将NO2还原;②在此条件下,NO2的转化率极低;
③ 。
(5)此实验装置存在一个明显的缺陷是 。
(6)为了验证NO2能被Na2O2氧化,该小组同学选用B、D、E装置,将B中的药品更换为Na2O2。另选F装置(如图2所示),重新组装,进行实验。装置的合理连接顺序是____。实验过程中,B装置中淡黄色粉末逐渐变成白色。经检验,该白色物质为纯净物,且无其他物质生成。推测B装置中反应的化学方程式为________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com