
【题目】有关①100mL 0.1 mol/L![]() 、②100mL 0.1 mol/L
、②100mL 0.1 mol/L![]() 两种溶液的叙述不正确的是
两种溶液的叙述不正确的是
A.溶液中水电离出的![]() 个数:②>①B.溶液中阴离子的物质的量浓度之和:②>①
个数:②>①B.溶液中阴离子的物质的量浓度之和:②>①
C.①溶液中:![]() D.②溶液中:
D.②溶液中:![]()
【答案】C
【解析】
A、因HCO3-的水解程度大于其电离程度,所以NaHCO3溶液显碱性;由于CO32-水解使得Na2CO3溶液也显碱性。根据越弱越水解原理可知,HCO3-的水解程度小于CO32-,弱离子水解程度越大,水的电离程度越大,所以相同浓度的NaHCO3和Na2CO3溶液中,水电离出的H+个数:②>①,A正确;
B、HCO3-水解生成H2CO3和OH-,即消耗一个HCO3-的同时又生成一个OH-,水解的过程中阴离子数不变;但CO32-的第一级水解生成HCO3-和OH-,即消耗一个CO32-的同时却生成了两个阴离子,水解的过程中,阴离子总数在增加;由于起始时CO32-和HCO3-的浓度相同,所以溶液中阴离子的物质的量浓度之和:②>①,B正确;
C、因HCO3-的水解程度大于其电离程度,所以①溶液中:c(H2CO3)>c(CO32-),C错误;
D、CO32-的第一级水解生成HCO3-,第二级水解生成H2CO3,且以第一级水解为主,所以②溶液中:c(HCO3-)>c(H2CO3),D正确;
答案选C。


科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数,下列说法正确的是
A.1molMgCl2中含有的离子数为2NA
B.标准状况下,11.2LH2O中含有的原子数为1.5NA
C.标准状况下,22.4L氦气与22.4L氯气所含原子数均为2NA
D.常温下,2.7g铝与足量的盐酸反应,失去的电子数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中反应①是制备SiH4的一种方法,其副产物MgCl2·6NH3是优质的镁资源。回答下列问题:

(1)MgCl2·6NH3所含元素的简单离子半径由小到大的顺序(H-除外):_________________________,Mg在元素周期表中的位置:_____________________,Mg(OH)2的电子式:____________________。
(2)A2B的化学式为_______________。反应②的必备条件是_______________。上图中可以循环使用的物质有_______________。
(3)在一定条件下,由SiH4和CH4反应生成H2和一种固体耐磨材料_______________(写化学式)。
(4)为实现燃煤脱硫,向煤中加入浆状Mg(OH)2,使燃烧产生的SO2转化为稳定的Mg化合物,写出该反应的化学方程式:_______________。
(5)用Mg制成的格氏试剂(RMgBr)常用于有机合成,例如制备醇类化合物的合成路线如下:
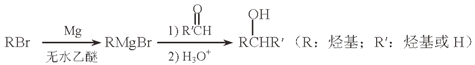
依据上述信息,写出制备![]() 所需醛的可能结构简式:_______________。
所需醛的可能结构简式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的核外电子排布式为[Ar]________,有________个未成对电子。
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是_________________________________________________。
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因____________________。
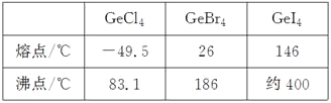
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是________________。
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为____________,微粒之间存在的作用力是________________。
(6)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置,下图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(![]() ,0,
,0,![]() );C为(
);C为(![]() ,
,![]() ,0)。则D原子的坐标参数为________。
,0)。则D原子的坐标参数为________。
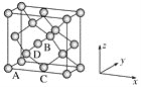
②晶胞参数,描述晶胞的大小和形状,已知Ge单晶的晶胞参数a=565.76 pm,其密度为________g·cm-3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向50mL 稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一段只对应一个反应。下列说法正确的是
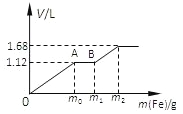
A. 开始时产生的气体为H2
B. AB段发生的反应为置换反应
C. 所用混合溶液中c(HNO3)=0.5 mol·L—1
D. 参加反应铁粉的总质量m2=5.6g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12分)已知某溶液中存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-) ②c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
填写下列空白:
(1)若溶液中只溶解了一种溶质,则该溶质是________,上述四种离子浓度的大小顺序为________(选填序号)。
(2)若上述关系中③是正确的,则溶液中的溶质为________;若上述关系中④是正确的,则溶液中的溶质为________。
(3)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)________c(NH3·H2O)(填“大于”“小于”或“等于”,下同),混合前酸中c(H+)和碱中c(OH-)的关系为c(H+)________c(OH-)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸雨形成的原理之一可表示如下:
含硫燃料![]() A
A![]() B
B![]() 硫酸
硫酸
请回答下列问题。
(1)A的化学式为__________,B的化学式为__________________________________。
(2)三个反应中,不属于氧化还原反应的是________(填序号)。
(3)SO2中硫元素显+4价,它可以降低到0价,利用这一性质可在工厂的烟道气中通入合适的________(填“氧化剂”或“还原剂”)除去SO2,达到减少污染的目的。
(4)雨水的pH小于5.6时,就判定为酸雨。已知pH=-lgc(H+),经测定某次雨水所含酸性物质只有硫酸,且其浓度为5×10-5mol·L-1,则这次降雨________(填“是”或“不是”)酸雨。
(5)火力发电厂燃烧的煤中含有大量的硫,其排出的废气中往往含有SO2、CO2等。为了除去有害的SO2气体,在英国已进行了一个研究,结果表明:高烟囱可以有效降低地面SO2的浓度。在20世纪60年代到70年代的10年间,由发电厂排放的SO2增加了35%,但由于高烟囱的建造,地面SO2浓度降低了30%之多。
①你认为减少酸雨产生可采取的措施是__________(填字母)。
A.少用煤作燃料 B.把工厂的烟囱建高
C.燃料脱硫 D.把工厂迁移到农村
E.开发新能源
②请从全球环境保护的角度,分析这种建高烟囱的方法是否可取?________(填“可取”或“不可取”),理由是__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水溶液X中只可能溶有K+、Mg2+、Al3+、AlO2-、SiO32-、SO32-、CO32-、SO42-中的若干种离子,某同学对该溶液进行了如下实验:

下列判断错误的是
A. 气体甲可能是混合物
B. 沉淀甲是硅酸和硅酸镁的混合物
C. 白色沉淀乙的主要成分是氢氧化铝
D. K+、AlO2-和SiO32-一定存在于溶液X中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】安全气囊逐渐成为汽车的标配,因为汽车发生剧烈碰撞时,安全气囊中迅速发生反应:10NaN3+2KNO3=K2O+5Na2O+16N2↑,产生大量的气体使气囊迅速弹出,保障驾乘车人员安全。下列关于该反应的说法正确的是
A.该反应中NaN3是氧化剂,KNO3是还原剂
B.氧化产物与还原产物的物质的量之比为1∶15
C.若有50.5 g KNO3参加反应,则有0.5mol N原子被还原
D.每转移1 mol e,可生成标准状况下N2的体积为2.24 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com