
��12�֣�����ʯ����������������þ����Ҫ�����������£�
I����ȡ������þ������Һ��������ʯ��ۣ����ˣ����ڳ��³�ѹ�½ᾧ���Ƶô�����þ
�����г���������Fe3+��Al3+��Fe2+���������ӣ���
II���ᴿ������þ����������þ�������������ܽ⣬����������0.1 mol/L H2O2��Һ����
������ҺpH��7��8���������ᴿ��
III����ȡ������þ������II������Һ�м��������ˮ��
��֪�������������������������pH
|
�� |
Fe3+ |
Al3+ |
Fe2+ |
Mg2+ |
|
��ʼ����ʱ |
1.5 |
3.3 |
6.5 |
9.4 |
|
������ȫʱ |
3.7 |
5.2 |
9.7 |
12.4 |
��ش�
��1������II�У������ڵ�����ҺpH��7~8������Լ���������������������ĸ��ţ���
���� A. MgO�������� B. Na2CO3���������� C.����ˮ
��2����ҵ�ϣ���ͨ���ⶨʹ���軯�أ�K3[Fe(CN) 6]����Һ����ɫ����H2O2��Һ������ȷ
��������þ��Fe2+�ĺ�������֪���ⶨ 123 g������þ��Ʒ�����ĵ�0.1 mol/L H2O2
��Һ��������±���ʾ��
|
�� |
ƽ�вⶨ���� |
ƽ��ֵ |
|||
|
ʵ���� |
1 |
2 |
3 |
4 |
|
|
����H2O2��Һ�����/mL |
0.32 |
0.30 |
0.30 |
0.32 |
0.31 |
Fe2+��H2O2��Һ��Ӧ�����ӷ���ʽΪ��������������������������
��3����ҵ�ϳ���Mg2+��ת����Ϊ����ָ�꣬ȷ������III�Ʊ���
����þ���չ��̵��������������У���Ӧ�¶���Mg2+ת����
�Ĺ�ϵ����ͼ��ʾ��
�� ����ͼ����ʾ 50��ǰ�¶���Mg2+ת����֮��Ĺ�ϵ������ �ϴ˷�Ӧ����������������ȡ����ȡ�����Ӧ��
��ͼ�У��¶������� 50������Mg2+ת�����½��Ŀ���ԭ�� ������������������������
��Ksp��ʾ�����ܽ�ƽ���ƽ�ⳣ������֪��
Mg(OH)2(s)  ��Mg2+ (aq)+ 2OH- (aq)������ Ksp = c(Mg2+)��c2(
OH-) = 5.6��10-12
��Mg2+ (aq)+ 2OH- (aq)������ Ksp = c(Mg2+)��c2(
OH-) = 5.6��10-12
Ca(OH)2(s) ��Ca2+ (aq) + 2OH- (aq)������ ��sp = c(Ca2+)��c2(OH-)
= 4.7��10-6
��Ca2+ (aq) + 2OH- (aq)������ ��sp = c(Ca2+)��c2(OH-)
= 4.7��10-6
����ʯ���������ˮ������������ܡ����ܡ����Ƶ�������þ�������� ���������� ��������
 ��ս�п�����ϵ�д�
��ս�п�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 ����ʯ����������������þ����Ҫ�����������£�
����ʯ����������������þ����Ҫ�����������£�| Fe3+ | Al3+ | Fe2+ | Mg2+ | |
| ��ʼ����ʱ | 1.5 | 3.3 | 6.5 | 9.4 |
| ������ȫʱ | 3.7 | 5.2 | 9.7 | 12.4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| Fe3+ | Al3+ | Fe2+ | Mg2+ | |
| ��ʼ����ʱ | 1.5 | 3.3 | 6.5 | 9.4 |
| ������ȫʱ | 3.7 | 5.2 | 9.7 | 12.4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| Fe3+ | Al3+ | Fe2+ | Mg2+ | |
| ��ʼ����ʱ | 1.5 | 3.3 | 6.5 | 9.4 |
| ������ȫʱ | 3.7 | 5.2 | 9.7 | 12.4 |
| ƽ�вⶨ���� | ƽ��ֵ | ||||
| ʵ���� | 1 | 2 | 3 | 4 | |
| ���� H2O2��Һ�����/mL | 0.32 | 0.30 | 0.30 | 0.32 | 0.31 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
��12�֣�����ʯ����������������þ����Ҫ�����������£�
I����ȡ������þ������Һ��������ʯ��ۣ����ˣ����ڳ��³�ѹ�½ᾧ���Ƶô�����þ
�����г���������Fe3+��Al3+��Fe2+���������ӣ���
II���ᴿ������þ����������þ�������������ܽ⣬����������0.1 mol/L H2O2��Һ����
������ҺpH��7��8���������ᴿ��
III����ȡ������þ������II������Һ�м��������ˮ��
��֪�������������������������pH
| �� | Fe3+ | Al3+ | Fe2+ | Mg2+ |
| ��ʼ����ʱ | 1.5 | 3.3 | 6.5 | 9.4 |
| ������ȫʱ | 3.7 | 5.2 | 9.7 | 12.4 |
��ش�
��1������II�У������ڵ�����ҺpH��7~8������Լ���������������������ĸ��ţ���
���� A. MgO�������� B. Na2CO3���������� C.����ˮ
��2����ҵ�ϣ���ͨ���ⶨʹ���軯�أ�K3[Fe(CN) 6]����Һ����ɫ����H2O2��Һ������ȷ
��������þ��Fe2+�ĺ�������֪���ⶨ 123 g������þ��Ʒ�����ĵ�0.1 mol/L H2O2
��Һ��������±���ʾ��
| �� | ƽ�вⶨ���� | ƽ��ֵ | |||
| ʵ���� | 1 | 2 | 3 | 4 | |
| ����H2O2��Һ�����/mL | 0.32 | 0.30 | 0.30 | 0.32 | 0.31 |
Fe2+��H2O2��Һ��Ӧ�����ӷ���ʽΪ��������������������������
��3����ҵ�ϳ���Mg2+��ת����Ϊ����ָ�꣬ȷ������III�Ʊ���
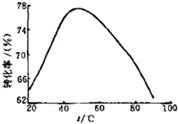
����þ���չ��̵��������������У���Ӧ�¶���Mg2+ת����
�Ĺ�ϵ����ͼ��ʾ��
�� ����ͼ����ʾ 50��ǰ�¶���Mg2+ת����֮��Ĺ�ϵ������ �ϴ˷�Ӧ����������������ȡ����ȡ�����Ӧ��
��ͼ�У��¶������� 50������Mg2+ת�����½��Ŀ���ԭ�� ������������������������
��Ksp��ʾ�����ܽ�ƽ���ƽ�ⳣ������֪��
Mg(OH)2(s) ��Mg2+ (aq)+ 2OH- (aq)������ Ksp = c(Mg2+)��c2(OH-) = 5.6��10-12
Ca(OH)2(s)��Ca2+ (aq) + 2OH- (aq)������ ��sp = c(Ca2+)��c2(OH-)= 4.7��10-6
����ʯ���������ˮ������������ܡ����ܡ����Ƶ�������þ������������������ ��������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com