
【题目】短周期元素 R、T、Q、W 在元素周期表中的相对位置如图所示,其中 T 所处的周期序数 与族序数相等。下列判断不正确的是
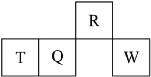
A.最简单气态氢化物的热稳定性:R>Q
B.最高价氧化物对应水化物的酸性:Q>R
C.原子半径:T>Q>R
D.含 T 的盐中,T 元素只能存在于阳离子中
【答案】BD
【解析】
由短周期元素R、T、Q、W的位置,可确定T、Q、W为第三周期的元素,R为第二周期元素,T所处的周期序数与族序数相等,则T为Al元素,因此Q为Si元素,W为S元素,R为N元素,结合元素周期律分析解答。
A.非金属性N>Si,故最简单气态氢化物的热稳定性为NH3>SiH4,故A正确;
B.非金属性N>Si,故最高价氧化物对应水化物的酸性为HNO3>H2SiO3,故B错误;
C.同周期自左而右,原子半径减小,同主族自上而下,原子半径增大,故原子半径:T>Q>R,故C正确;
D.T为铝元素,其盐溶液中可能为铝盐、也可能为偏铝酸盐,Al元素可能存在于阳离子中,也可能存在于阴离子中,故D错误;
故选BD。


科目:高中化学 来源: 题型:
【题目】(1)下列装置属于原电池的是________。
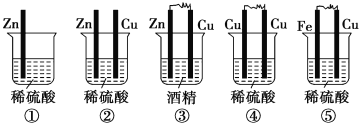
(2)在选出的原电池中,________是负极,发生________反应,________是正极,该极的现象是______________________________。
(3)此原电池反应的化学方程式为_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4.铝土矿的主要成分为氧化铝、氧化铁和二氧化硅,工业上经过下列工艺可以冶炼金属铝:

下列说法中错误的是( )
A. ①②中除加试剂外,还需要进行过滤操作
B. a、b中铝元素的化合价相同
C. ③中需要通入过量的氨气
D. ④进行的操作是加热,而且d一定是氧化铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列溶液中微粒浓度关系一定正确的是( )
A.0.1mol·L-1Na2CO3溶液中,加水稀释,![]() 的值减小
的值减小
B.0.1mol·L-1的硫酸铝溶液中:c(SO42-)>c(Al3+)>c(H+)>c(OH-)
C.pH=7的氨水与氯化铵的混合溶液中:c(Cl-)>c(NH4+)
D.pH=2的醋酸溶液和pH=12的NaOH溶液等体积混合:c(Na+)=c(CH3COO-)+c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】α氯乙基苯是一种重要的有机合成中间体,其一种制备反应原理为![]() +Cl2(g)
+Cl2(g)![]() +HCl(g) ΔH
+HCl(g) ΔH
在T1℃时,向2.0 L恒容密闭容器中充入0.40 mol乙苯(g)和0.40 mol Cl2(g)进行反应,反应过程中测定的部分数据见下表:
t/min | 0 | 1 | 2 | 5 | 10 |
n(HCl)/mol | 0 | 0.12 | 0.20 | 0.32 | 0.32 |
下列有关说法正确的是 ( )
A.T1℃时,反应在0~2min内的平均速率v(α-氯乙基苯)=0.05mol·L-1·s-1
B.10min后,若保持其他条件不变,升高温度至T2℃,达到新平衡时测得c(α-氯乙基苯)=0.18mol·L-1,则反应的ΔH>0
C.温度从T1℃升至T2℃时,正向反应速率增大,逆向反应速率减小
D.T1℃时,体系的总压不变时,反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(NH4)2SO4是一种常见的化肥,某工厂用石膏、NH3、H2O和CO2制备(NH4)2SO4的工艺流程如下:

下列说法正确的是
A. 通入NH3和CO2的顺序可以互换
B. 操作2为将滤液加热浓缩、冷却结晶、过滤,可得(NH4)2SO4
C. 步骤②中反应的离子方程式为Ca2++2NH3+CO2+H2O=CaCO3↓+2NH4+
D. 通入的NH2和CO2均应过量,且工艺流程中CO2可循环利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下。下列说法不正确的是( )

A. O2在电极b上发生还原反应
B. 溶液中OH-向电极a移动
C. 反应消耗的NH3与O2的物质的量之比为4∶5
D. 负极的电极反应式为2NH3-6e-+6OH-===N2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,对于反应2NO2(g)![]() N2O4(g) △H<0,增大压强(体积迅速减小),下列说法正确的是( )
N2O4(g) △H<0,增大压强(体积迅速减小),下列说法正确的是( )
A.平衡逆向移动
B.混合气体颜色比原来深
C.混合气体颜色比原来浅
D.混合气体的平均相对分子质量变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下反应:A2(g)+3 B2(g)![]() 2 AB3(g) (每生成2 mol AB3放出92.4 kJ的热量),在恒温恒压的密闭容器中进行如下实验:①通入1 mol A2和3 mol B2,达平衡时放出热量为Q1,②通入2 mol A2和6 mol B2,达平衡时放出热量为Q2,则下列关系正确的是
2 AB3(g) (每生成2 mol AB3放出92.4 kJ的热量),在恒温恒压的密闭容器中进行如下实验:①通入1 mol A2和3 mol B2,达平衡时放出热量为Q1,②通入2 mol A2和6 mol B2,达平衡时放出热量为Q2,则下列关系正确的是
A.Q2 = 2 Q1 B.2Q1 < Q2
C.Q1 < Q2 < 92.4 kJ D.Q1 = Q2 < 92.4 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com