
| A.溶液中c(H+)=c(Cl—) |
| B.与等体积pH=12的氨水混合后所得溶液显酸性 |
| C.由盐酸电离出的H+约为由H2O电商出H+浓度的l010倍 |
| D.与等体积0.01 moI·L-1碳酸钠溶液混合后所得溶液中:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
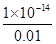 =1×10-12mol/L。溶液中c(OH—)=c水(H+)=1×10-12mol/L,所以由盐酸电离出的H+约为由H2O电商出H+浓度的l010倍,C正确;D、与等体积0.01 moI/L碳酸钠溶液混合,恰好反应生成碳酸氢钠和氯化钠。根据物料守恒可知c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),D不正确,答案选C。
=1×10-12mol/L。溶液中c(OH—)=c水(H+)=1×10-12mol/L,所以由盐酸电离出的H+约为由H2O电商出H+浓度的l010倍,C正确;D、与等体积0.01 moI/L碳酸钠溶液混合,恰好反应生成碳酸氢钠和氯化钠。根据物料守恒可知c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),D不正确,答案选C。

 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源:不详 题型:单选题
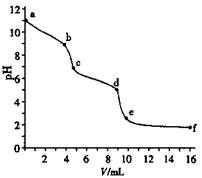
| A.该Na2CO3溶液的浓度为0.001 mol·L—1 |
| B.在pH ="6" 时,c(Na+)>c(HCO3—)>c(CO32—) |
| C.在pH ="7" 时,c(Na+)=c(Cl—) |
| D.c→d发生的主要离子反应:CO32—+H+=HCO3— |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
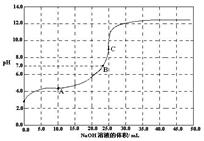
| A.滴定前,酸中c(H+) 等于碱中c(OH-) |
| B.在A点,c(Na+) > c(X-)> c(HX)> c(H+)> c(OH-) |
| C.在B点,两者恰好完全反应 |
| D.在C点,c(X-) + c(HX) ="0.05" mol/L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 实验编号 | c(HA)/ mo1·L-l | c(NaOH)/ mol·L-1 | 反应后溶液pH |
| 甲 | 0.1 | 0.1 | pH =9 |
| 乙 | c1 | 0.2 | pH =7 |
 H++A-
H++A-查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| 难溶物 | Ksp |
| Ca3(AsO4)2 | 6.8×10-19 |
| CaSO4 | 9.1×10-6 |
| FeAsO4 | 5.7×10-21 |
| 污染物 | H2SO4 | As |
| 废水浓度 | 29.4g/L | 1.6g·L-1 |
| 排放标准 | pH 6~9 | 0.5mg·L-1 |
 HAsO42-+OH-,该步水解的平衡常数(25℃)为: (保留两位有效数字)。
HAsO42-+OH-,该步水解的平衡常数(25℃)为: (保留两位有效数字)。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.5 L 2 mol·L-1 AlCl3溶液中,Al3+和Cl-总数小于4×6.02×1023个 |
| B.制成0.5 L 10 mol·L-1的盐酸,需要标准状况下的氯化氢气体112 L |
| C.从1 L 1 mol·L-1的NaCl溶液中移取出10 mL溶液,其浓度是1 mol·L-1 |
| D.10 g 98%的硫酸(密度为1.84 g·cm-3)与10 mL18.4 mol·L-1的硫酸的浓度不同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CH3COONa浓溶液 | B.1mol?L-1氨水 |
| C.1mol?L-1H2SO4 | D.2mol?L-1CH3COOH |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.常温下,将pH=3的醋酸溶液加水稀释到原体积的10倍后,溶液的pH=4 |
| B.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
| C.pH=13的NaOH溶液与pH=1的醋酸溶液等体积混合后所得溶液的pH>7 |
| D.向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中:c(NH4+) = c(Cl-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com