
| A. | 恒温恒压下,若混合气体密度不变,说明反应已达平衡 | |
| B. | 恒容时通入氩气,压强不变,正逆反应速率也不变 | |
| C. | 降低温度可以缩短反应达到平衡的时间 | |
| D. | 恒容时通入X2,平衡向正反应方向移动,平衡常数不变 |
分析 A.恒温恒压条件下气体质量不变,体积不变密度不变,说明物质浓度不变,反应达到平衡状态;
B.恒容时通入氩气,总压增大,气体分压不变,正逆反应速率不变;
C.降低温度反应速率减小;
D.恒容时通入X2,平衡正向进行,温度不变平衡常数不变;
解答 解:A.恒温恒压条件下气体质量不变,体积不变,才能使气体密度不变,当密度不变物质浓度不变,反应达到平衡状态,故A正确;
B.恒容时通入氩气,总压增大,气体分压不变,正逆反应速率不变,故B错误;
C.降低温度反应速率减小,反应达到平衡的时间增长,故C错误;
D.恒容时通入X2,平衡正向进行,温度不变平衡常数不变,故D正确;
故选AD.
点评 本题考查了化学平衡、化学反应速率影响因素分析判断,注意容器的特征分析,题目难度中等.


科目:高中化学 来源: 题型:选择题
 伏打电堆(Voltaic pile)的照片和结构如图.它用圆形的锌板、铜板间隔堆积而成.所有的圆板之间夹放几层盐水泡过的布.下列说法正确的是( )
伏打电堆(Voltaic pile)的照片和结构如图.它用圆形的锌板、铜板间隔堆积而成.所有的圆板之间夹放几层盐水泡过的布.下列说法正确的是( )| A. | 伏打电堆能将电能转化成化学能 | B. | 锌是正极 | ||
| C. | 盐水是电解质溶液 | D. | 伏打电堆工作时铜被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知K=$\frac{{c}^{2}C{O}_{2}•{c}^{6}•{H}_{2}}{{c}^{3}{H}_{2}O•cC{H}_{3}C{H}_{2}OH}$,则对应的化学反应可以表示为2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g) | |
| B. | 将某浓度氢氟酸溶液升高温度,氢氟酸的电离度(α)和电离平衡常数Ka都变大 | |
| C. | 常温下,向纯水中加入碳酸钠,水的电离程度变大,KW变大 | |
| D. | 化学平衡常数K与温度有关,随温度的升高,K可能增大也可能减小,或者不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
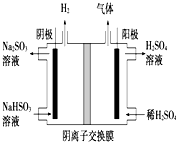 硫酸工业用SO2制取SO3的反应为:2SO2+O2 $?_{加热}^{催化剂}$2SO3△H=-47kJ/mol.不同温度下,反应的平衡常数如表:
硫酸工业用SO2制取SO3的反应为:2SO2+O2 $?_{加热}^{催化剂}$2SO3△H=-47kJ/mol.不同温度下,反应的平衡常数如表:| 温 度 | 200℃300℃400℃ |
| 平衡常数 | K1 K2 K3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+ | |
| B. | 气体通过无水硫酸铜,粉末变蓝,证明原气体中含有水蒸气 | |
| C. | 灼烧白色粉末,火焰成黄色,证明原粉末中有Na+,无K+ | |
| D. | 在溶液中加稀盐酸,无现象,继续加入BaCl2溶液产生白色沉淀,证明原溶液有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
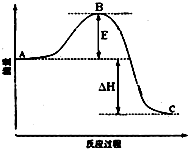 安徽金和上市公司近期新增硫酸生产线.其主要反应 为:2SO2(g)+O2(g)═2SO3(g),该反应过程的能量变化如图所示.
安徽金和上市公司近期新增硫酸生产线.其主要反应 为:2SO2(g)+O2(g)═2SO3(g),该反应过程的能量变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
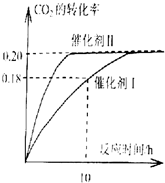 已知CO2可以生产绿色燃料甲醇,反应如下:
已知CO2可以生产绿色燃料甲醇,反应如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com