
【题目】25℃时,浓度均为0.1mol/L的溶液,其pH如下表所示。有关说法正确的是
序号 | ① | ② | ③ | ④ |
溶液 |
|
|
|
|
pH | 7.0 | 7.0 | 8.1 | 8.9 |
A. 酸性强弱: ![]()
B. 离子的总浓度:①>③
C. ②中: ![]()
D. ②和④中![]() 相等
相等
【答案】B
【解析】由表中数据得到,碱性:NaF<CH3COONa,所以说明阴离子的水解能力:F-<CH3COO-,根据越弱越水解的原理,得到酸性: ![]() 。选项A错误。①③两个溶液有各自的电荷守恒式:c(Na+) + c(H+) = c(Cl-) + c(OH-);c(Na+) + c(H+) = c(F-) + c(OH-),所以两个溶液的离子总浓度都等于各自的2[c(Na+) + c(H+)],因为两个溶液中的钠离子浓度相等,所以只需要比较两个溶液的氢离子浓度即可。pH为:①<③,所以①的氢离子浓度更大,即溶液①的2[c(Na+) + c(H+)]大于溶液③的2[c(Na+) + c(H+)],所以离子的总浓度:①>③,选项B正确。溶液②中,pH=7,所以c(H+) = c(OH-) = 1×10-7mol/L。明显溶液中的醋酸根和铵根离子的浓度都接近0.1mol/L(电离和水解的程度都不会太大),所以应该是
。选项A错误。①③两个溶液有各自的电荷守恒式:c(Na+) + c(H+) = c(Cl-) + c(OH-);c(Na+) + c(H+) = c(F-) + c(OH-),所以两个溶液的离子总浓度都等于各自的2[c(Na+) + c(H+)],因为两个溶液中的钠离子浓度相等,所以只需要比较两个溶液的氢离子浓度即可。pH为:①<③,所以①的氢离子浓度更大,即溶液①的2[c(Na+) + c(H+)]大于溶液③的2[c(Na+) + c(H+)],所以离子的总浓度:①>③,选项B正确。溶液②中,pH=7,所以c(H+) = c(OH-) = 1×10-7mol/L。明显溶液中的醋酸根和铵根离子的浓度都接近0.1mol/L(电离和水解的程度都不会太大),所以应该是![]() 。选项C错误。醋酸铵中,铵根离子对于醋酸根离子的水解起到促进作用,醋酸钠中钠离子对于醋酸根离子的水解应该无影响,所以醋酸根离子浓度是②<④,选项D错误。
。选项C错误。醋酸铵中,铵根离子对于醋酸根离子的水解起到促进作用,醋酸钠中钠离子对于醋酸根离子的水解应该无影响,所以醋酸根离子浓度是②<④,选项D错误。


科目:高中化学 来源: 题型:
【题目】对下列实验事故或废弃药品的处理方法正确的是
A.当有大量毒气泄漏时,人应沿顺风方向疏散
B.实验室里电线失火,首先要断开电源
C.用滴管滴加液体时,滴管下端紧贴试管内壁
D.酒精失火用水浇灭
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列实验事实:
①![]() 固体既能溶于
固体既能溶于![]() 溶液得到
溶液得到![]() 溶液,又能溶于硫酸得到
溶液,又能溶于硫酸得到![]() 溶液;
溶液;
②向![]() 溶液中滴加
溶液中滴加![]() 溶液,再酸化,可得
溶液,再酸化,可得![]() 溶液;
溶液;
③将![]() 溶液滴加到淀粉和KI的混合溶液中,溶液变蓝。
溶液滴加到淀粉和KI的混合溶液中,溶液变蓝。
下列判断不正确的是
A. 化合物![]() 中
中![]() 元素为+3价
元素为+3价
B. 实验①证明![]() 是两性氧化物
是两性氧化物
C. 实验②证明![]() 既有氧化性又有还原性
既有氧化性又有还原性
D. 实验③证明氧化性: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C7H8的某有机物,它能使酸性高锰酸钾溶液褪色,但不能与溴水反应.该有机物在一定条件下与H2完全加成,其生成物的一氯代物的种类有( )
A.3种
B.4种
C.5种
D.6种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是最重要的氮肥,是产量最大的化工产品之一.德国人哈伯在1905年发明了合成氨的方法,其合成原理为:N2(g)+3H2(g)2NH3(g)△H=﹣92.4kJmol﹣1 , 他因此获得了1918年诺贝尔化学奖. 在密闭容器中,使2mol N2和6mol H2混合发生下列反应:N2(g)+3H2(g)2NH3(g)(正反应为放热反应)
(1)当反应达到平衡时,N2和H2的转化率比是 .
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量 ,
密度 . (填“变大”“变小”或“不变”)
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将(填“正向”“逆向”或“不”)移动.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤块的主要成分是MgCl2 , 此外还含Fe2+、Fe3+和Mn2+等杂质离子.以卤块为原料按下图所示流程进行生产,可制得轻质氧化镁. 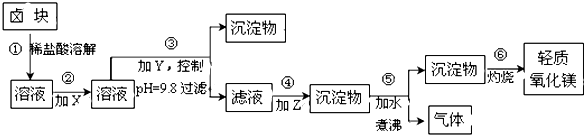
查阅资料得下表相关数据:
表1:生成氢氧化物沉淀的pH | 表2:原料价格表 | |||
物质 | 开始沉淀 | 沉淀完全 | 物质 | 价格(元/吨) |
Fe(OH)3 | 2.7 | 3.7 | a.漂液(含25.2%NaClO) | 450 |
Fe(OH)2 | 7.6 | 9.6﹡ | b.双氧水(含30%H2O2) | 2400 |
Mn(OH)2 | 8.3 | 9.8 | c.烧碱(含98%NaOH) | 2100 |
Mg(OH)2 | 9.6 | 11.1 | d.纯碱(含99.5%Na2CO3) | 600 |
﹡Fe2+氢氧化物呈絮状,不易从溶液中除去,必须将它氧化后以Fe(OH)3沉淀形式才能除尽.
若要求产品尽量不含杂质且生产成本较低,请根据上表提供的资料回答:
(1)流程中加入的试剂X,Y,Z最佳选择依次是表2中的(选填试剂编号).
(2)步骤②发生反应的离子方程式为;步骤⑤中发生反应的化学方程为 .
(3)步骤③控制pH=9.8的目的是 .
(4)若在实验室进行步骤⑥的灼烧实验,必须用到的仪器是铁三脚、酒精喷灯、和泥三角.
(5)在探究Mg(OH)2溶解性的实验中,发现向装有少量Mg(OH)2浊液的试管中加入适量NH4Cl晶体,充分振荡后溶液会变澄清,请用化学平衡的原理解释浊液变澄清的原因 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学欲探究Na2O2与水的反应,可供使用的试剂有:Na2O2、蒸馏水、KMnO4酸性溶液、MnO2。该同学取4 g Na2O2样品与过量水反应,待完全反应后,得100 mL溶液X和448 mL O2(已折算为标准状况)。该同学推测反应中可能生成了H2O2,并进行实验探究。
⑴试设计实验证明溶液X中含过氧化氢_________________。
⑵通过上述实验证明溶液中确实存在H2O2。取少量X于试管中,滴加几滴酚酞试液,实验现象为___________。
⑶取少量X于试管中,滴加FeCl2溶液,立即生成红褐色沉淀,则该反应的离子方程式为___________。
⑷已知溶液X可使酸性KMnO4溶液褪色,同时放出氧气,完成并配平该反应的离子方程式:____
![]() ________MnO4-+ ________H2O2 + ________H+ — ________Mn2+ + ________O2↑ + __________。
________MnO4-+ ________H2O2 + ________H+ — ________Mn2+ + ________O2↑ + __________。
取100 mL 溶液X,使其与过量酸性KMnO4溶液反应,最终生成224 mL O2(已折算为标准状况),则此样品中Na2O2的质量分数是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组在实验室模拟用软锰矿(主要成分![]() ,杂质为铁及铜的化合物等)制备高纯碳酸锰,过程如下(部分操作和条件略):
,杂质为铁及铜的化合物等)制备高纯碳酸锰,过程如下(部分操作和条件略):
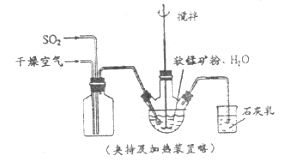
①缓慢向烧瓶中(见上图)通入过量混合气进行“浸锰”操作,主要反应原理为: ![]()
![]() (铁浸出后,过量的
(铁浸出后,过量的![]() 会将
会将![]() 还原为
还原为![]() )
)
②向“浸锰”结束后的烧瓶中加入一定量纯![]() 粉末。
粉末。
③再用![]() 溶液调节pH为3.5左右,过滤。
溶液调节pH为3.5左右,过滤。
④调节滤液pH为6.5-7.2,加入![]() ,有浅红色沉淀生成,过滤、洗涤、干燥,得到高纯碳酸锰。
,有浅红色沉淀生成,过滤、洗涤、干燥,得到高纯碳酸锰。
(1)“浸锰”反应中往往有副产物![]() 的生成,温度对“浸锰”反应的影响如下图,为减少
的生成,温度对“浸锰”反应的影响如下图,为减少![]() 的生成,“浸锰”的适宜温度是___________。
的生成,“浸锰”的适宜温度是___________。
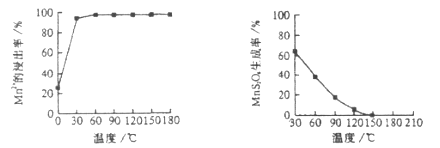
图1 温度对锰浸出率的影响 图2 浸锰温度与![]() 生成率的关系
生成率的关系
(2)查阅表1,③中调pH为3.5时沉淀的主要成分是________。②中加入一定量纯![]() 粉末的主要作用是_________,相应反应的离子方程式为_______。
粉末的主要作用是_________,相应反应的离子方程式为_______。
表1:生成相应氢氧化物的pH
物质 |
|
|
|
|
| 开始沉淀pH | 2.7 | 7.6 | 8.3 | 4.7 |
完全沉淀pH | 3.7 | 9.6 | 9.8 | 6.7 |
(3)③中所得的滤液中含有![]() ,可添加过量的难溶电解质MnS除去
,可添加过量的难溶电解质MnS除去![]() ,经过滤,得到纯净的
,经过滤,得到纯净的![]() 。用平衡移动原理解释加入MnS的作用__________。
。用平衡移动原理解释加入MnS的作用__________。
(4)④中加入![]() 后发生反应的离子方程式是__________。
后发生反应的离子方程式是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com