
分析 (1)依据用浓溶液配制一定物质的量浓度稀溶液一般步骤选择需要的仪器;
(2)①A.先计算浓硫酸的物质的量浓度,然后根据稀释过程中硫酸的物质的量不变进行计算需要浓硫酸溶液的体积;
E.依据定容的正确操作解答;
②用浓溶液配制一定物质的量浓度稀溶液一般步骤:计算、量取、稀释、移液、洗涤、定容、摇匀等,据此排序;
③依据浓硫酸体积选择合适规格的容量瓶;
④如果对装有浓硫酸的量筒仰视读数,导致量取浓硫酸体积偏大,依据C=$\frac{n}{V}$进行误差分析;
⑤容量瓶不能盛放过热液体,所以移液前,应进行冷却.
解答 解:(1)用浓溶液配制一定物质的量浓度稀溶液一般步骤:计算、量取、稀释、移液、洗涤、定容、摇匀等,用到的仪器:量筒、胶头滴管、烧杯、玻璃棒、容量瓶,配制100mL物质的量浓度为1mol/L的稀硫酸需要100mL容量瓶;所以还缺少的仪器:100ml容量瓶、胶头滴管;
故答案为:100ml容量瓶、胶头滴管;
(2)①A.质量分数为98%,密度为1.84g•cm-3的浓硫酸物质的量浓度C=$\frac{1000ρω}{M}$=$\frac{1000×1.84×98%}{98}$=18.4mol/L,
设需要浓硫酸体积V,则依据稀释过程中硫酸的物质的量不变得:V×18.4mol/L=1mol/L×100mL,解得V=5.4mL;
故答案为:5.4;
E.定容时,将蒸馏水直接加入容量瓶,至液面接近刻度线1-2cm,改用胶头滴管逐滴滴加到凹液面与刻度线相切;
故答案为:1-2cm;
②用浓溶液配制一定物质的量浓度稀溶液一般步骤:计算、量取、稀释、移液、洗涤、定容、摇匀等,所以正确的操作顺序为:DACBEGF;
故答案为:DACBEGF;
③依据A可知需要浓硫酸体积为5.4mL,所以应选择10mL量筒,
故选A;
④如果对装有浓硫酸的量筒仰视读数,导致量取浓硫酸体积偏大,则溶质的物质的量偏大,溶液浓度偏高;
故答案为:偏高;
⑤容量瓶不能盛放过热液体,而浓硫酸稀释产生大量的热,所以移液前,应冷却到室温;
故答案为:冷却至室温.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理及操作步骤是解题关键,注意误差分析的方法和技巧,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
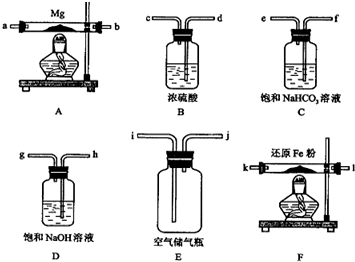
| 装置 | 目的 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
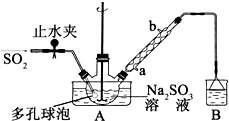 次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O)俗称吊白块,不稳定,120℃时会分解.在印染、医药以及原子能工业中有广泛应用.以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:
次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O)俗称吊白块,不稳定,120℃时会分解.在印染、医药以及原子能工业中有广泛应用.以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡时c(NH3)=5mol/L | |
| B. | 平衡时HI分解率为20% | |
| C. | 混合气体的平均摩尔质量不再发生变化不可以作为判断该反应达到平衡状态的标志 | |
| D. | 平衡后缩小容器体积,NH4I的物质的量增加,I2的物质的量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸铵在室温下能自发发生分解,是由于反应生成了易挥发的气体,使体系的熵增大 | |
| B. | 同一种物质气态时熵值最大,液态时次之,而固态时熵值最小 | |
| C. | 与外界隔离的体系,自发过程将导致体系的熵减小 | |
| D. | 在一定条件下,非自发进行的反应也能够发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
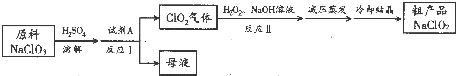
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用物质A表示2 s内的平均反应速率为0.3 mol/(L•s) | |
| B. | 用物质B表示2s内的平均反应速率为0.6 mol/(L•s) | |
| C. | 2 s后物质B的浓度为0.35 mol/L | |
| D. | 2 s后物质A的转化率为30% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用丁达尔效应区分溶液和胶体 | |
| B. | 将1.0molFeCl3全部制成胶体,其中氢氧化铁胶粒为NA个 | |
| C. | Fe(OH)3胶体的电泳实验说明了胶体粒子带有电荷 | |
| D. | 江河入海口三角洲的形成,通常与胶体的性质有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 左盘高 | B. | 右盘高 | C. | 仍保持平衡 | D. | 不能确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com