A、B、C、X均为常见的纯净物,它们之间有如下转化关系(副产品已略去).
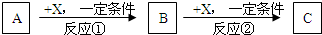
试回答:
(1)若X是强氧化性单质,则A不可能是
de
de
.
a.S b.N
2 c.Na d.Mg e.Al
(2)若X是金属单质,向C的水溶液中滴入AgNO
3溶液,产生不溶于稀HNO
3的白色沉淀,则B的化学式为
FeCl3
FeCl3
;C溶液在贮存时应加入少量X,理由是(用必要的文字和离子方程式表示)
2Fe3++Fe═3Fe2+ 保证溶液中Fe2+为主
2Fe3++Fe═3Fe2+ 保证溶液中Fe2+为主
.检验此C溶液中金属元素价态的操作方法是
向溶液中滴加少量KSCN溶液,无明显现象,通入少量Cl2溶液呈血红色
向溶液中滴加少量KSCN溶液,无明显现象,通入少量Cl2溶液呈血红色
.
(3)若A、B、C为含某金属元素的无机化合物,X为强电解质,A溶液与C溶液反应生成B,则B的化学式为
Al(OH)3
Al(OH)3
,X的化学式可能为(写出不同类物质)
HCl
HCl
或
NaOH
NaOH
.反应①的离子方程式为
AlO2-+H++H2O═Al(OH)3↓或Al3++3OH-═Al(OH)3↓
AlO2-+H++H2O═Al(OH)3↓或Al3++3OH-═Al(OH)3↓
.




 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案 Al(OH)3
Al(OH)3 Al3++3OH-
Al3++3OH- Al(OH)3
Al(OH)3 Al3++3OH-
Al3++3OH-

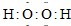
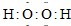
 A、B、C、X是中学化学中常见的物质,它们之间的转化关系如图所示(部分产物已略去).请回答下列问题:
A、B、C、X是中学化学中常见的物质,它们之间的转化关系如图所示(部分产物已略去).请回答下列问题: A、B、C、X是中学化学中常见的物质,它们之间的转化关系如下图所示(部分产物已略去).请回答下列问题:
A、B、C、X是中学化学中常见的物质,它们之间的转化关系如下图所示(部分产物已略去).请回答下列问题: