
【题目】除去乙烷中混有的少量乙烯,最好的方法是( )
A. 将混合气体点燃
B. 将混合气体在催化剂条件下跟氢气反应
C. 将混合气体通过溴水
D. 将混合气体通过酸性 KMnO4 溶液
科目:高中化学 来源: 题型:
【题目】对于反应 3 Cu + 8 HNO3 = 3 Cu(NO3)2 + 2NO↑+ 4H2O,以下叙述正确的是( )
A. 氧化剂和还原剂的物质的量比为8: 3
B. 被还原的HNO3和起酸性作用的HNO3的物质的量的比为2∶3
C. 该反应的电子转移数为6e-
D. 该反应中Cu(NO3)2 为氧化产物,H2O为还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家冶炼出了纯度高达 99.999%的铁,估计它不会具有的性质是( )
A. 硬度比生铁低
B. 在潮湿的空气中放置不易生锈
C. 与 4mol/L 盐酸的反应速率比生铁快
D. 在冷的浓硫酸中可以钝化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯水中含有多种成分,因而具有多重性质。根据氯水分别与如图四种溶液发生的反应填空(a、b、c、d重合部分代表物质间反应,且氯水足量)。

⑴能证明氯水具有漂白性的是_________________(填“a”、“b”、“c”或“d”);
⑵a过程中的化学方程式为____________________;
b过程中的离子方程式为____________________;
⑶发生了氧化还原反应的是:________填“a”、“b”、“c”或“d”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 向氨水中不断通入CO2,随着CO2的增加,![]() 不断减小
不断减小
B. 在铜的精炼过程中,若转移1mol电子,则阳极一定溶解32gCu
C. 常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)的△H>0,△S<0
D. 将下图中的活塞快速推至A处固定,气体颜色先变深、再变浅,但比起始时深

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E是化学中常见的物质,常温下,E是一种无色无味的液体,它们之间有如下反应关系。
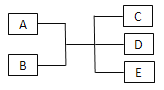
(1)若A是一种红色金属单质,B是一种常见的挥发性酸,反应时生成的C是无色气体,反应的离子方程式为___________,若反应放出1.12 L气体(标准状况下),则被还原的B物质的量为___________mol。
(2)若实验室中利用固体A和B的反应制备气体C,C是一种无色、刺激性气味、密度比空气小、碱性的气体,试写出此反应的化学方程式________________;实验室检验C的方法为_______________。
(3)若B是黄绿色有毒气体,上述关系经常用于实验室尾气处理,则反应的离子方程式为________________。若用湿润的淀粉碘化钾试纸靠近盛满B的试管口,看到的现象为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与材料、生活和环境密切相关。下列有关说法中不正确的是
A. 棉、丝、毛都是天然有机高分子化合物
B. 玻璃钢是由玻璃纤维和合成树脂组成的复合材料
C. 聚氯乙烯(PVC)一次性超薄袋可用于包装熟食
D. 侯氏制碱法的工艺过程中应用了物质溶解度的差异
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘单质在水溶液中溶解度很小,但在CCl4中溶解度很大,原因是
A.CCl4与I2分子量相差较小,而H2O与I2分子量相差较大
B.CCl4与I2都是直线型分子,而H2O不是直线型分子
C.CCl4和I2都不含氢元素,而H2O中含有氢元素
D.CCl4和I2都是非极性分子,而H2O是极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用0.50 mol·L-1NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol·L-1NaOH溶液
(1)若实验中大约要使用245mLNaOH溶液,至少需要称量NaOH固体 g。
(2)从下图中选择称量NaOH固体所需要的仪器是(填字母): 。
名称 | 托盘天平 (带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
仪器 |
|
|
|
|
|
|
序号 | a | b | c | d | e | f |
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。

(1)不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是 。
(2)在操作正确的前提下,提高中和热测定准确性的关键是_____________。大烧杯如不盖硬纸板,求得的中和热数值将 (填“偏大”、“偏小”或“无影响”)。结合日常生活实际该实验在 中(家用产品)效果更好。
(3)写出该反应中和热的热化学方程式:(中和热为57.3 kJ·mol-1) 。
(4)取50 mLNaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
试验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.6 | |
2 | 27.0 | 27.4 | 27.2 | 31.2 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
表中的温度差平均值为 ℃。
②近似认为0.50 mol·L-1 NaOH溶液和0.50 molL-1硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c = 4.18 J·(g·℃)-1。则中和热ΔH= (取小数点后一位)。
③上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是(填字母) 。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
④实验中改用60mL0.5mol/L盐酸跟50mL0.55 mol·L-1氢氧化钠进行反应,与上述实验相比,所放出的热量 (填相等或不相等,下同),所求的中和热 简述理由 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com