
| A. | 同一元素不可能既表现金属性,又表现非金属性 | |
| B. | 第三周期元素的最高正化合价等于它所处的主族序数 | |
| C. | 短周期中同主族元素的最外层电子数及化学性质完全相同 | |
| D. | 同周期元素的原子半径从左到右依次减小 |
分析 A.位于金属与非金属元素交界处的元素,既有金属性又有非金属性;
B.第三周期元素均为主族元素,最高正化合价等于它所处的主族序数;
C.同主族元素原子最外层电子数相同,化学性质具有相似性,自上而下原子半径增大,化学性质具有递变性;
D.除稀有气体外,同周期元素的原子半径从左到右依次减小.
解答 解:A.位于金属与非金属元素交界处的元素,既有金属性又有非金属性,如Si既表现金属性,又表现非金属性,故错误;
B.第三周期元素均为主族元素,最高正化合价等于它所处的主族序数等于最外层电子数,故B正确;
C.同主族元素原子最外层电子数相同,自上而下原子半径增大,化学性质具有相似性、递变性,化学性质不完全相同,故C错误;
D.除稀有气体外,同周期元素的原子半径从左到右依次减小,故D错误;
故选B.
点评 本题考查元素周期律与元素周期表的综合应用,难度不大,侧重对基础知识的巩固,注意短周期元素的特殊性.


科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ②③ | D. | ⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10g H${\;}_{2}^{18}$O中所含的中子数为4NA | |
| B. | 1mol苯分子中含有的碳碳双键数为3NA | |
| C. | 标准状况下,22.4LCl2完全反应,转移的电子数一定是2NA | |
| D. | 常温下,1L0.1mol/L Na2CO3溶液中的阴离子总数大于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用稀硝酸处理铁片 | B. | 用稀盐酸处理铁片 | ||
| C. | 用浓硝酸处理铁片 | D. | 用浓盐酸处理铁片 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
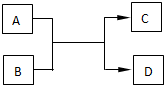 学习了元素周期表,可以帮助我们进一步丰富不同元素间的相互转化关系.已知A、B、C、D都处于短周期,A、D为单质,B、C是化合物.
学习了元素周期表,可以帮助我们进一步丰富不同元素间的相互转化关系.已知A、B、C、D都处于短周期,A、D为单质,B、C是化合物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丁硫醇、甲硫醇与乙硫醇互为同系物 | |
| B. | 沸点不同的丁硫醇有四种 | |
| C. | 丁硫醇在空气中燃烧生成二氧化碳、二氧化硫和水 | |
| D. | 在水溶液中,乙硫醇比乙醇更难电离出H+离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
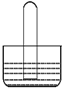
| A. | 若水槽中是水,试管中是NO2,可看到液面上升,若充入一定量的O2可使液体充满整个试管 | |
| B. | 若水槽中是NaOH溶液,试管中是Cl2,可看到液面上升、试管中黄绿色褪去 | |
| C. | 若水槽中是水并滴有几滴紫色石蕊,试管中是SO2,可看到液面上升并变为无色 | |
| D. | 若水槽中是水并滴有几滴酚酞,试管中是NH3,可看到液面上升并呈红色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com