
【题目】按要求完成下列填空。
(1)下列几组物质中,互为同分异构体的是________;互为同系物的是________。
A.CH2=CH-COOH和油酸(C17H33COOH)
B.12C60和石墨
C.乙醇和乙二醇
D.35Cl和37Cl
E.![]() 和
和![]()
(2)下图是某有机物的球棍模型,该有机物的分子式为_________;名称为________。

(3)在有机化学分析中,根据反应的性质和反应产物,即可确定烯烃的组成和结构(双键及支链的位置),例如:

据以上线索和下列反应事实,确定C7H14的结构和名称:

该烃的结构筒式为_____________,名称是____________。
【答案】 E A C9H11NO2 苯丙氨酸 CH3CH(CH3)C(CH3)=CHCH3 3,4-二甲基-2-戊烯
【解析】(1)A.CH2=CH-COOH和油酸(C17H33COOH)是同系物;B.12C60和石墨是同素异形体;C.乙醇和乙二醇均为醇,不是同系物,也不是同分异构体;D.35Cl和37Cl是同位素;E. ![]() 和
和![]() 分子式相同,是同分异构体;则互为同分异构体的是E;互为同系物的是A;
分子式相同,是同分异构体;则互为同分异构体的是E;互为同系物的是A;
(2)根据碳的四价、氧的二价及氮的三价可知此有机物的结构简式为, ,分子式为C9H11NO2;名称为苯丙氨酸;
,分子式为C9H11NO2;名称为苯丙氨酸;
(3)根据信息可知,产物乙醛醛基碳原子与酮中羰基碳原子直接相连且为碳碳双键,即为C7H14的结构简式,则答案为CH3CH(CH3)C(CH3)=CHCH3,根据系统命名法,其化学名称为3,4-二甲基-2-戊烯。


 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】A、B、C三种金属,A中混有C时A先腐蚀,A与B组成原电池,A为电池正极,则A、B、C三种金属的活动性顺序为
A.A>B>C B.A>C>B C.B>A>C D.B>C>A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛化合物常见价态有+2和+4。钛白粉(TiO2,两性氧化物)用途广泛。工业上由高钛渣(主要成分为Ti3O5,还含有TiO2、Fe2O3等)制取钛白粉的主要工艺过程如下:
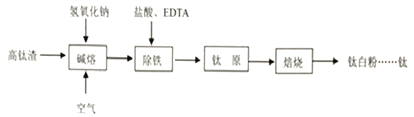
(1)写出碱熔步骤所发生反应的化学方程式____________、____________。
(2)实验测定EDTA加入量(EDTA和Fe3+的物质的量之比)对 Ti4+和Fe3+溶出率的影响如图所示。由图可知,EDTA的加入量为____________时除铁效率最佳,理由是____________。

(3)在实验室模拟除铁净化后的实验步骤:①向钛原料中加入稀硫酸生成偏钛酸(H2TiO3)沉淀,反应结束后过滤;②洗涤;③……;④在650℃下高温焙烧得到较纯的钛白粉固体。步骤③的实验目的是____________,需要用到的试剂有____________。
(4)测定钛白粉纯度:称取试样0.200g在CO2气氛下用金属铝将钛(IV)还原成钛(Ⅲ),还原后的溶液以NH4SCN为指示剂,用0.08mol/L的 NH4Fe(SO4)2标准液滴定,滴定终点时消耗标准液29.20mL,钛白粉的纯度为____________。(保留三位有效数字)
(5)最新研究发现也可以用图示装置由TiO2获得金属钛。装置中阳极的电极反应方程式为____________,在制备金属钛前后,整套装置中CaO的总量____________(填写“增大”、“减小”或者“不变”)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1L0.1mol.L-1的K2SO4溶液中
A.K+的物质的量为0.1 mol B.SO42-的物质的量为0.2mol
C.K+的物质的量浓度为0. 1mol.L-1 D. SO42-的物质的量浓度为0. 1mol.L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锶(Sr)为第五周期IIA族元素,其化合物六水氯化锶(SrCl2·6H2O)是实验室重要的分析试剂,工业上常以天青石(主要成分为SrSO4)为原料制备,生产流程如下:

(1)SrCl2的电子式为_____________。
(2)工业上天青石隔绝空气高温焙烧,若0.5 mol SrSO4中只有S被还原,转移了4 mol电子。写出该反应的化学方程式:_______________________。
(3)加入硫酸的目的是______________________。为了提高原料的利用率,滤液中Sr2+的浓度应不高于_________ mol/L(注:此时滤液中Ba2+浓度为1×10-5mol/L;SrSO4和BaSO4溶度积常数依次为3×10-7、1×10-10。)
(4)产品纯度检测:称取1.000 g产品溶解于适量水中,向其中加入含AgNO31.100×10-2mol的AgNO3溶液(溶液中除Cl-外,不含其它与Ag+反应的离子),待Cl-完全沉淀后,用含Fe3+的溶液作指示剂,用0.2000 mol/L的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出。
①滴定反应达到终点的现象是_______________________。
②若滴定过程用去上述浓度的NH4SCN溶液20.00 mL,则产品中SrCl2·6H2O的质量百分含量为______________(保留4位有效数字)。
(5)工业上常用电解熔融SrCl2制锶单质。由SrCl2·6H2O制取无水氯化锶的方法是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是利用一种微生物将废水中的有机物(假设是淀粉)的化学能直接转化为电能,并利用此电能在铁上镀铜,下列说法中正确的是
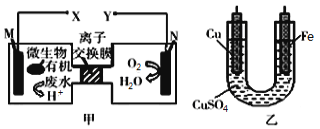
A.质子透过离子交换膜由右向左移动
B.铜电极应与X相连接
C.M电极反应式:(C6H10O5)n+7nH2O-24ne-=6nCO2↑+24nH+
D.当N电极消耗0.25mol气体时,则铁电极增重16g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 熟石灰用于燃煤烟气脱硫
B. 硅常用作光导纤维
C. 碳酸钠治疗胃酸过多
D. 用FeCl2溶液与Cu反应制作印刷电路板
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于原电池的叙述正确的是
A. 构成原电池的正极和负极必须是两种不同的金属
B. 原电池是将化学能转变为电能的装置
C. 原电池中电子流出的一极是负极,该极被还原
D. 原电池工作时,电流的方向是从负极到正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中属于吸热反应的是
A. 镁跟盐酸反应 B. 乙醇的燃烧
C. 盐酸与氢氧化钠溶液反应 D. Ba(OH)2·8H2O晶体与NH4Cl晶体的反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com