
【题目】下列指定反应的离子方程式正确的是
A. 钠与水反应: Na +2H2O![]() Na++2OH– + H2↑
Na++2OH– + H2↑
B. 向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3﹒H2O=Al(OH)3↓+3NH4+
C. 向氢氧化钡溶液中加入稀硫酸: Ba2++OH– + H+ + ![]()
![]() BaSO4↓+H2O
BaSO4↓+H2O
D. 向碳酸氢铵溶液中加入足量石灰水: Ca2++![]() +OH–
+OH–![]() CaCO3↓+H2O
CaCO3↓+H2O
科目:高中化学 来源: 题型:
【题目】MnO2是常见的氧化剂、催化剂和活性电极材料。
(1)工业上,以惰性材料为电极,电解MnSO4溶液(含少量稀硫酸)制备MnO2。写出阳极的电极反应式:___________。
(2)已知如下热化学方程式(K代表平衡常数):
①MnCO3(s)![]() MnO(s)+CO2(g) △H1 K1
MnO(s)+CO2(g) △H1 K1
②2MnO(s)+O2(g)![]() 2MnO2(s) △H2 K2
2MnO2(s) △H2 K2
③2MnCO3(s)+O2(g)![]() 2MnO2(s)+2CO2(g) △H3 K3
2MnO2(s)+2CO2(g) △H3 K3
△H3=______(用△H1、△H2表示) K3=_______(用K1、K2表示)。
(3)反应②在低温条件下能自发进行,则△H2______0(填“>”“<”或“=”)。
(4)在密闭容器中投入足量的MnCO3,—定条件下发生反应:MnCO3(s)![]() MnO(s)+CO2(g)
MnO(s)+CO2(g)
△H>0。在一定温度下,达到平衡状态时p(CO2)=2a MPa。

① 温度、压强对MnCO3分解率的影响如图所示:比较:L1____L2(填“>”“<”或“=”)。
② 保持温度不变,将容器体积扩大至原来的2倍,则p(CO2)的变化范围是______。
③ 保持温度不变,将容器体积压缩至原来的一半,达到新平衡时下列物理量-定不变的是__(填代号)。
A.平衡常数K B.c(CO2) C.n(CO2) D.m(MnCO3)
(5)—定温度下,在容积为2L的恒容密闭容器中加人足量的MnCO3(s)和5molO2,发生反应:2MnCO(s)+O2(g)![]() 2MnO2(s)+2CO2(g),CO2以平均速率0.1mol L-1·min-1经过10min达到平衡状态。该条件下该反应的平衡常数K为_______。
2MnO2(s)+2CO2(g),CO2以平均速率0.1mol L-1·min-1经过10min达到平衡状态。该条件下该反应的平衡常数K为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氧化碳是一种用途相当广泛的化工基础原料。
⑴. 利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍。
Ni(s)+4CO(g)![]() Ni(CO)4(g) 该反应的ΔH_______0(选填“>”或“=”或“<”)。
Ni(CO)4(g) 该反应的ΔH_______0(选填“>”或“=”或“<”)。
⑵. 在高温下一氧化碳可将二氧化硫还原为单质硫。已知:
C(s)+O2(g)=CO2(g);ΔH1=-393.5 kJ·mol-1
CO2(g)+C(s)=2CO(g);ΔH2=+172.5 kJ·mol-1
S(s)+O2(g)=SO2(g);ΔH3=-296.0 kJ·mol-1
则2CO(g)+SO2(g)=S(s)+2CO2(g) ΔH4=________。
⑶. 工业上一般采用CO与H2反应合成可再生能源甲醇,反应如下:
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应达到平衡后,测
得c(CO)=0.2mol·L-1,则CO的转化率为___________。
合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,通过反应进行甲醇合成,T1℃下此反应的平衡常数为160。此温度下,在密闭容器中加入一定量CO和H2,反应到某时刻测得各组分的浓度如下:
物质 | H2 | CO | CH3OH |
浓度/(mol·L-1) | 0.2 | 0.1 | 0.4 |
比较此时正、逆反应速率的大小:v正_______v逆 (填“>”、“<”或“=”);若其他条件不变,在T2℃反应10min后达到平衡,c(H2)=0.4 mol·L-1,则该时间内反应速率:
v(CH3OH) =__________;
(4)金属氧化物被一氧化碳还原生成金属单质和二氧化碳。下图是四种金属氧化物被一氧化碳还原时lg[c(CO)/c(CO2)]与温度(t)的关系曲线图。800℃时,其中最易被还原的金属氧化物是____(填化学式),该反应的平衡常数数值(K)等于____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知mmol某气体的质量为a g,则b g该气体在标准状况下的体积(L)为
A.22.4bm/a B. 22.4b/am C.22.4am/b D.22.4a/bm
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2的利用对促进低碳社会的构建具有重要意义。
(1)将CO2与焦炭作用生成CO,CO可用子炼铁等。
①已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH1=akJ·mol-1
C(石墨)+CO2(g)=2CO(g) ΔH2=bkJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为______________。
(2)将CO2转化为甲醇的热化学方程式为: CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H
CH3OH(g)+H2O(g) △H
取一定体积CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中,发生上述反应。
①下列情况能说明反应已达平衡状态的是________(填字母)。
A.容器内气体密度不变 B.容器内气体总压强保持不变
C.绝热恒容时,平衡常数不变 D.v正(CH3OH)=3v逆(H2)
②反应过程中测得甲醇的体积分数α(CH3OH)与反应温度T的关系如图所示,则该反应的ΔH______0(填“>”、“<”或“=”)。
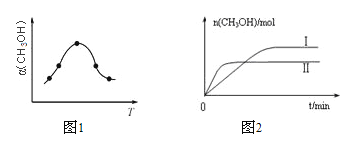
③在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图所示,曲线I、Ⅱ对应的平衡常数大小关系为KⅠ_____KⅡ(填“>”、“<”或“=”)。
(3)以CO2为原料还可以合成多种物质。
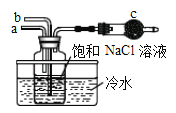
①如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。操作中先在_____处通入NH3气体,然后再在_______处通入CO2气体。
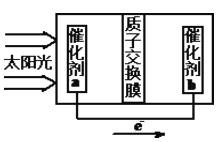
②人工光合作用能够借助太阳能用CO2和水制备化学原料,右图是通过人工光合作用制备HCOOH的原理示意图,请写出催化剂b处的电极反应式:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下相等质量的SO2气体和CO2气体,下列有关比较的叙述中,正确的是( )
①分子数之比为11:16 ②体积比为16:11
③密度比为16:11 ④体积比为1:1.
A.①③ B.②④ C.②③ D.①④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com