
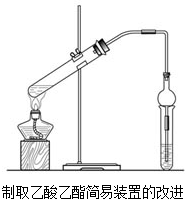
 现用如图装置制取乙酸乙酯.请回答:
现用如图装置制取乙酸乙酯.请回答:

 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:阅读理解
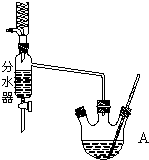 如图为制取乙酸乙酯的实验装置图.回答下列问题:
如图为制取乙酸乙酯的实验装置图.回答下列问题:| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
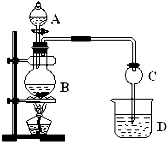 某化学兴趣小组设计实验制取乙酸乙酯.现用如图装置进行实验,在圆底烧瓶内加入碎瓷片,再加入由2mL 98%的浓H2SO4和3mL乙醇组成的混合液,通过分液漏斗向烧瓶内加入2mL冰醋酸,烧杯中加入饱和Na2CO3溶液.请回答下列问题:
某化学兴趣小组设计实验制取乙酸乙酯.现用如图装置进行实验,在圆底烧瓶内加入碎瓷片,再加入由2mL 98%的浓H2SO4和3mL乙醇组成的混合液,通过分液漏斗向烧瓶内加入2mL冰醋酸,烧杯中加入饱和Na2CO3溶液.请回答下列问题:查看答案和解析>>
科目:高中化学 来源:2009届上海市南汇中学高三年级零次月考、化学试卷 题型:058
乙酸乙酯是重要的工业原料和溶剂.现利用如图装置制取乙酸乙酯的粗产品,再测定乙酸乙酯的含量.

(1)写出反应方程式________(反应)
(2)实验室一般用饱和碳酸钠溶液接收反应的生成物.若不振荡该试管,可看到的现象是________,若振荡该试管,可看到的现象是________,但是有却出现了白色晶体,该晶体是________;
(3)对于制乙酸乙酯的上述装置,为了提高产率,请提出一条改进意见:
________.
(4)为测定乙酸乙酯的含量,进行如下操作:
(Ⅰ)准确称量20.0 g乙酯乙酯粗品于锥形瓶中,用0.50 mol/L NaOH滴定(酚酞做示剂).终点时消耗NaOH溶液的体积为40.0 mL
(Ⅱ)另取20.0 g乙酸乙酸粗产品于250 mL锥形瓶中,加入100 mL的2.1 mol/L NaOH溶液混合增色匀后,装上冷凝管,在水浴上加热回流约1小时,装置如图所示.待冷却后,用0.50 mol/LHC1滴定过量的NaOH.终点时消耗盐酸的体积为20.0 mL.
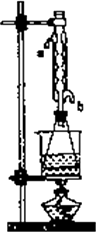
回答:①实验(Ⅰ)中达到滴定终点时的现象是________.
②实验(Ⅱ)中冷水从冷水凝管的________(填a或b)管口通入.
③利用实验(Ⅰ)、(Ⅱ)测量的数据计算粗产物中乙酸乙酯的质量分数为________.
查看答案和解析>>
科目:高中化学 来源: 题型:
 (08上海松江区模拟)乙酸乙酯是重要的工业原料和溶剂。现利用如图
(08上海松江区模拟)乙酸乙酯是重要的工业原料和溶剂。现利用如图
装置制取乙酸乙酯粗产品,再测定乙酸乙酯的含量。
⑴写出此反应的化学方程式
;
该反应要在浓硫酸存在的条件下进行,浓硫酸的作用是
;
⑵实验室一般用饱和碳酸钠溶液接收反应的生成物。若不
振荡该试管,可看到的现象是 ,若振
荡该试管,可看到的现象是 ,但有时却出现了白色晶体,该晶体是 ;
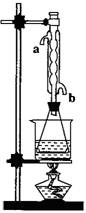 ⑶对于制乙酸乙酯的上述装置,为了提高产率,请提出
⑶对于制乙酸乙酯的上述装置,为了提高产率,请提出
一条改进意见:
。
⑷为测定乙酸乙酯的含量,进行了如下操作:
(I)准确称量20.0g乙酸乙酯粗品于锥形瓶中,用0.50mol/L
NaOH滴定(酚酞做指示剂)。终点时消耗NaOH溶液的体积为
40.0mL;
(II)另取20.0g乙酸乙酯粗产品于250mL锥形瓶中,加入100mL
2.1mol/LNaOH溶液混合均匀后,装上冷凝管,在水浴上加热回
流约1小时,装置如图所示。待冷却后,用0.50mol/LHCl滴定
过量的NaOH。终点时消耗盐酸的体积为20.0mL。
回答:
①实验(I)中达到滴定终点时的现象是 。
②实验(II)中冷水从冷水凝管的 (填a或b)管口通入。
③利用实验(I)、(II)测量的数据计算粗产物中乙酸乙酯的质量分数为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com