
【题目】下列条件中,两种气体所含原子数一定相等的是( )
A.同质量、不同密度的N2和CO
B.同温度、同体积的H2和N2
C.同体积、同密度的C2H6和NO
D.同压强、同体积的N2O和CO2
【答案】A
【解析】解:两瓶气体所含原子数一定相等,则含有原子物质的量相等.
A.二者质量相等,摩尔质量相等为28g/mol,根据n= ![]() 可知,二者物质的量一定相等,二者都是双原子分子,含有原子数目一定相等,故A正确;
可知,二者物质的量一定相等,二者都是双原子分子,含有原子数目一定相等,故A正确;
B.同温度、同体积的H2和N2 , 二者压强不一定相等,二者的物质的量不一定相等,含有原子数目不一定相等,故B错误;
C.同体积、同密度的C2H6和NO,二者质量相等,C2H6和NO含有原子数目之比= ![]() ×8:
×8: ![]() ×2=4:1,故C错误;
×2=4:1,故C错误;
D.同压强、同体积的N2O和CO2 , 二者的温度不一定相等,二者的物质的量不一定相等,二者都是三原子分子,故含有原子数目不一定相等,故D错误,
故选A.


科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的数值,下列说法中,正确的是( )
A. 标准状况下,22.4L Cl2完全溶于水时,转移的电子数为NA
B. 16g甲基中含有的质子数目为10NA
C. 标准状况下,2.24L NH3中含有的共价键数目为NA
D. 常温下,23g NO2和N2O4的混合气体中含有NA个氧原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为____________________________________。利用反应6NO2+8NH3![]() 7N2+12H2O也可处理NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下是________L。
7N2+12H2O也可处理NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下是________L。
(2)已知反应NO2(g)+SO2(g) ![]() SO3(g)+NO(g) ΔH=-41.8kJ·mol-1。一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,测得上述反应平衡时NO2与SO2的体积比为1∶6,则平衡常数K=________。
SO3(g)+NO(g) ΔH=-41.8kJ·mol-1。一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,测得上述反应平衡时NO2与SO2的体积比为1∶6,则平衡常数K=________。
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) ![]() CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。该反应ΔH_____0(填“>”或“<”)。实际生产条件控制在250℃、1.3×104 kPa左右,选择此压强的理由是_______________________。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。该反应ΔH_____0(填“>”或“<”)。实际生产条件控制在250℃、1.3×104 kPa左右,选择此压强的理由是_______________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g)![]() Z(g)+W(s)ΔH>0下列叙述正确的是( )
Z(g)+W(s)ΔH>0下列叙述正确的是( )
A. 加入少量W,逆反应速率增大
B. 当容器中气体压强不变时,反应达到平衡
C. 升高温度,平衡逆向移动
D. 平衡后加入X,上述反应的ΔH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在水溶液中1molCl-,ClOx(x=1,2,3,4)的能量(kJ)相对大小如图所示.下列有关说法正确的是( )
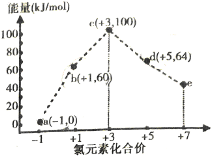
A.e是ClO3-
B.b→a+c反应的活化能为60kJmol-1
C.a,b,c,d,e中c最稳定
D.b→a+d反应的热化学方程式为3ClO-(aq)=ClO3-(aq)+2Cl-(aq)△H=-116kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在春暖花开的季节,广州处处鸟语花香,这里的“花香”体现的化学知识是( )
A. 分子是不停运动的
B. 分子只有在特定的季节才会运动
C. 分子是不可再分的
D. 分子只有在特定的空间才会运动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠、钾的碘化物在生产和科学实验中有十分重要的应用。工业上利用碘、烧碱和铁屑为原料可生产碘化钠,其生产流程如图所示:

(1)NaOH溶液和碘反应时需要严格控制温度,如果温度过低,会生成碘的低价副产品NaIO。若NaOH溶液和碘反应时所得溶液中IO3-与IO-的物质的量之比为1:1,则该反应的离子方程式为________________________________。
(2)生产流程中加入过量铁屑的目的是___________________,过滤所得固体中除剩余铁屑外,还有红褐色固体,则加入铁屑时发生反应的化学方程式是_________。
(3)溶液2中除含有H+外,一定含有的阳离子是__________________;试设计实验证实该金属阳离子的存在:____________________________。
(4)溶液2经一系列转化可以得到草酸亚铁晶体(FeC2O4·2H2O),称取3.60g草酸亚铁晶体用热重法对其进行热分解,得到剩余固体的质量随温度变化的曲线如图所示:

①分析图中数据,写出过程I发生反应的化学方程式:__________________________;
②300℃时剩余固体是铁的一种氧化物,通过计算确定该氧化物的化学式: ________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g)![]() 4NO(g) + 6H2O(g),下列叙述正确的是
4NO(g) + 6H2O(g),下列叙述正确的是
A.平衡时,v正(O2)=v逆(O2)必成立
B.关系式5v正(O2)=4v正(NO)总成立
C.用上述四种物质NH3、O2、NO、H2O表示的正反应速率的数值中,v正(H2O)最小
D.若投入4 mol NH3和5 mol O2,通过控制外界条件,必能生成4 mol NO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com