
【题目】氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2。某同学在实验室中对NH3与NO2反应进行了探究。回答下列问题:
(1)氨气的制备
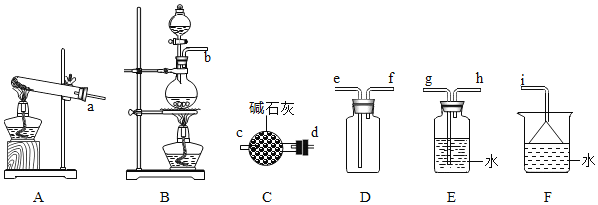
(2)氨气的发生装置可以选择上图中的________,反应的化学方程式为_______________。
(3)欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→_________(按气流方向,用各接口小写字母表示)。
(4)氨气与二氧化氮的反应
将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。
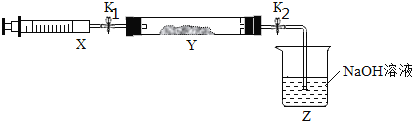
在一定温度下按上图所示装置进行实验。
操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 | Y管中______ | 反应的化学方程式:___ |
将注射器活塞退回原处并固定,将装置恢复到室温 | Y管中有少量水珠 | 生成的气态水冷凝 |
打开K2 | _________ | ________ |
【答案】A Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O d→c→f→e→i 红棕色气体颜色变浅最终为无色 8NH3+6NO2
CaCl2+2NH3↑+2H2O d→c→f→e→i 红棕色气体颜色变浅最终为无色 8NH3+6NO2![]() 7N2+12H2O Z中NaOH溶液产生倒吸现象 反应后气体分子数减少,Y管中压强小于外压
7N2+12H2O Z中NaOH溶液产生倒吸现象 反应后气体分子数减少,Y管中压强小于外压
【解析】
本题是实验室制氨气的实验探究活动。一般在实验室中,利用氢氧化钙与氯化铵混合加热发生复分解反应制取氨气,由于反应物均为固体,因此选用略向下倾斜试管进行实验。发生该反应的化学方程式为Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O;在对气体进行除杂、干燥时,考虑到氨气是碱性气体,所以需要利用碱性干燥剂进行干燥,又因为氨气的密度比空气的密度小且极易溶于水,因此氨气只能用向下排空气法收集。最后为了防止氨气对环境产生污染,需要对氨气进行尾气处理。
CaCl2+2NH3↑+2H2O;在对气体进行除杂、干燥时,考虑到氨气是碱性气体,所以需要利用碱性干燥剂进行干燥,又因为氨气的密度比空气的密度小且极易溶于水,因此氨气只能用向下排空气法收集。最后为了防止氨气对环境产生污染,需要对氨气进行尾气处理。
(2)在实验室中,利用氢氧化钙与氯化铵混合加热发生复分解反应制取氨气,由于反应物均为固体,因此选用A装置进行实验。发生该反应的化学方程式为Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O。答案为:A、Ca(OH)2+2NH4Cl
CaCl2+2NH3↑+2H2O。答案为:A、Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
(3)利用A装置制取氨气,由于氨气是碱性气体,所以需要利用碱性干燥剂碱石灰进行干燥,再根据氨气的密度比空气的密度小这一性质,需用向下排空气法收集氨气 ,最后因为氨气对环境具有一定的污染性,需要进行尾气处理,可利用其在水中极容易溶解的性质,用水作吸收剂进行尾气处理。因此欲收集一瓶干燥的氨气,其装置的连接顺序为:发生装置→d→c→f→e→i。答案为:d→c→f→e→i ;
(4)NO2具有强氧化性,NH3有强还原性,两者相遇,会发生氧化还原反应产生氮气和水,根据电子守恒、原子守恒,可得反应的方程式:8NH3+6NO2![]() 7N2+12H2O,根据反应方程式可知反应现象是:Y管内看到红棕色气体颜色变浅最终为无色,同时在注射器的内壁有水珠产生。答案为:红棕色气体颜色变浅最终为无色、8NH3+6NO2
7N2+12H2O,根据反应方程式可知反应现象是:Y管内看到红棕色气体颜色变浅最终为无色,同时在注射器的内壁有水珠产生。答案为:红棕色气体颜色变浅最终为无色、8NH3+6NO2![]() 7N2+12H2O;
7N2+12H2O;
根据上一步分析可知发生该反应后由于容器内气体的物质的量减少,所以会使容器内气体压强减小。因此当打开K2后,烧杯内NaOH溶液在大气压强的作用下会倒吸进入Y管内。答案为:Z中NaOH溶液产生倒吸现象、反应后气体分子数减少,Y管中压强小于外压。


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
【题目】烟气中主要污染物SO2、NOx,为消除排放,保护环境,实现绿色可持续发展。
处理方法一:烟气经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量。O3氧化烟气中SO2、NO的主要反应的热化学方程式为:
NO(g)+O3(g)=NO2(g)+O2(g) △H1
NO(g)+1/2O2(g)=NO2(g) △H2
SO2(g)+O3(g)![]() SO3(g)+O2(g) △H3
SO3(g)+O2(g) △H3
(1)反应3NO(g)+O3(g)=3NO2(g)的△H=_________。
(2) 室温下,进入反应器的NO、SO2的物质的量恒定,改 变通入O3的物质的量,反应一段时间后体系中n(NO)、n(NO2)和n(SO2)随反应前n(O3):nNO)的变化见图。说明预处理过程中NO2的物质的量变化的原因_______,在反应中SO2的物质的量几乎不发生变化的原因是_______________。

(3)在一定条件下,SO2(g)+O3(g)![]() SO3(g)+O2(g) △H3<0,在一定温度下,向2L某恒容密闭容器中充入4molSO2(g)和1molO3(g),5min时,测得容器中SO3(g)的物质的量为0.5mol。
SO3(g)+O2(g) △H3<0,在一定温度下,向2L某恒容密闭容器中充入4molSO2(g)和1molO3(g),5min时,测得容器中SO3(g)的物质的量为0.5mol。
①0-5min内,用SO2表示的平均反应速率v(SO2)________。
②下列说法中能判断该反应达到平衡状态的是________
a.单位时间内生成nmolSO2同时生成nmolSO3
b.SO3和O2的物质的量浓度之比1:1
C.容器内压强保持不变
d.混合气体的密度不变
e.混合气体的平均相对分子质量不变
处理方法二: 也可采用NaClO2溶液作为吸收剂对烟气进行处理。在不同温度下,NaClO2溶液脱硫(S)、脱硝(N)的反应中,SO2和NO的平衡分压Pe如图所示。

(4) 由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均_______(填“增大”、“不变”或“减小”)。
(5) 反应ClO2-+2SO32-![]() 2SO42-+Cl-的平衡常数K表达式为_______。
2SO42-+Cl-的平衡常数K表达式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】油脂是重要的营养物质.某天然油脂A可发生下列反应:

已知:A的分子式为C57H106O6.1mol该天然油脂A经反应①可得到1molD、1mol不饱和脂肪酸B和2mol直链饱和脂肪酸C.经测定B的相对分子质量为280,原子个数比为C:H:O=9:16:1;
(1)写出B的分子式:________________________;
(2)写出反应①的反应类型:____________;C的名称(或俗称)是_________;
(3)近日,电视媒体关于“氢化油危害堪比杀虫剂”的报道引发轩然大波,反应②为天然油脂的氢化过程.下列有关说法不正确的是_______________;
a.氢化油又称人造奶油,通常又叫硬化油.
b.植物油经过氢化处理后会产生副产品反式脂肪酸甘油酯,摄入过多的氢化油,容易堵塞血管而导致心脑血管疾病.
c.氢化油的制备原理是在加热植物油时,加入金属催化剂,通入氢气,使液态油脂变为半固态或固态油脂.
d.油脂的氢化与油脂的皂化都属于加成反应
(4)D和足量金属钠反应的化学方程式_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用阴离子交换膜控制电解液中OH-的浓度制备纳米Cu2O,反应为2Cu+H2O![]() Cu2O+H2↑,装置如图,下列说法中正确的是
Cu2O+H2↑,装置如图,下列说法中正确的是
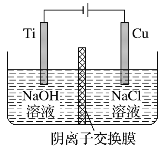
A. 电解时Cl-通过交换膜向Ti极移动
B. 阳极发生的反应为:2Cu -2e- +2OH- = Cu2O+H2O
C. 阴极OH-放电,有O2生成
D. Ti电极和Cu电极生成物物质的量之比为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将等体积的NO和 NO2充入试管,并将试管倒立于水槽中,充分反应后剩余气体的体积缩小为原体积的 ( )
A.1/2B.1/3C.3/8D.2/3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置,在锥形瓶中,分别加入足量的下列物质,反应后可能产生喷泉的是( )

A. 铜与稀盐酸B. 碳酸氢钠与氢氧化钠溶液
C. 碳酸钙与稀硫酸D. 碳酸氢铵与稀盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】导电聚合物的合成使高分子材料进入“合成金属”和塑料电子学时代,下图所示是我国化学家近年来合成的一些导电聚合物衍生物分子(Me指甲基):
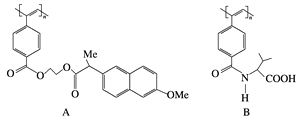
下列关于上述高分子的说法正确的是( )
①A和B的单体都是二烯烃的衍生物;
②A和B均能在一定条件下水解形成分子式相同的高分子化合物;
③B水解所得的小分子是一种α氨基酸;
④A和B各1 mol与热碱液反应,均最多消耗2 mol NaOH
A. ② B. ②③ C. ②③④ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列用来表示物质变化的化学用语中,正确的是( )
A. 氢氧碱性燃料电池的负极反应式:O2+2H2O+4e-![]() 4OH-
4OH-
B. 粗铜精炼时与电源正极相连的是纯铜,主要电极反应式:Cu-2e-=Cu2+
C. 钢铁发生电化学腐蚀的负极反应式:Fe-3e-![]() Fe3+
Fe3+
D. 钢闸门应与外接电源的负极相连,起保护作用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com