
 研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.
研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.分析 (1)依据热化学方程式和盖斯定律计算得到所需热化学方程式,①-②×3得到所需热化学方程式;
(2)CO-O2燃料电池(以KOH溶液为电解液),依据原电池原理,负极失电子发生氧化反应,燃料在负极失电子发生氧化反应;
(3)①化学反应的平衡常数随着温度的变化而变化;
②根据化学反应三行式来计算转化率和平衡常数.
解答 解:(1)①由①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1
②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJ•mol-1
依据盖斯定律①-②×3得到热化学方程式为:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5 kJ•mol-1,
故答案为:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5 kJ•mol-1;
(2)CO-O2燃料电池(以KOH溶液为电解液),一氧化碳在负极失电子发生氧化反应生成二氧化碳在溶液中生成碳酸钾,原电池负极电极反应为:CO+4OH--2e-=CO32-+2H2O,
故答案为:CO+4OH--2e-=CO32-+2H2O;
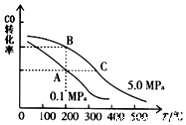
(3)①根据图中CO的平衡转化率(α)与温度、压强的关系,A、B两点的温度是一样的,所以平衡常数相等,故答案为:=;
②将2.0mol CO和6.0mol H2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.25mol/L,则
CO(g)+2H2(g)═CH3OH(g)
初始浓度:1.0 3.0 0
变化浓度:0.75 1.5 0.75
平衡浓度:0.25 1.5 0.75
CO的转化率$\frac{0.75}{1}$×100%=75%,此温度下的化学平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)•{c}^{3}({H}_{2})}$=$\frac{0.75}{0.25×1.{5}^{2}}$≈1.3,故答案为:75%,1.3.
点评 本题考查了热化学方程式书写、原电池及电解池工作原理、化学反应速率以及化学平衡常数、转化率是现在考试的热点,注意三行式在计算中的应用,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | NH4C1固体和Ba(OH)2晶体在常温下混合即可反应,是因为该反应是放热反应 | |
| B. | CO(g)的燃烧热是-283.0 KJ/mol,则 2CO2(g)═2CO(g)+O2(g)的反应热 为△H=+566.0 KJ/mol | |
| C. | 含1 mol Ba(OH)2的溶液和含1 mol H2SO4的溶液反应放出的热量是中和热 | |
| D. | 1 mol CH4燃烧生成水蒸气和二氧化碳所放出的热量是甲烷的燃烧热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
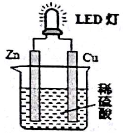
| A. | 如果将硫酸换成橙汁,导线中不会有电子流动 | |
| B. | 氢离子在铜片表面被还原 | |
| C. | 锌是负极,电子从锌片经导线流向铜片 | |
| D. | 装置中存在化学能→电能→光能”的转换 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ②乙烯③CH3COOH④CH3CH2OH⑤CH2═CH-COOH ⑥
②乙烯③CH3COOH④CH3CH2OH⑤CH2═CH-COOH ⑥
| A. | ①⑤ | B. | ①②④⑥ | C. | ①④ | D. | ①③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | N≡N |
| 键能/kJ•mol-1 | 435 | 943 |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
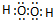 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇、氯化钠、氨气、干冰 | B. | 碳酸、氯化钠、乙酸、冰 | ||
| C. | 草酸、碳酸氢钠、氯化钠、碳酸钙 | D. | 硫酸、硫酸钡、醋酸铵、胆矾 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com