
在一恒温、恒容密闭容器中充入1mol CO2和3 mol H2,一定条件下发生反应:
CO2(g)+3H2(g) CH3OH (g)+H2O(g) △H=-49.0 kJ/mol
CH3OH (g)+H2O(g) △H=-49.0 kJ/mol
某种反应物和生成物的浓度随时间变化如图所示。回答下列问题: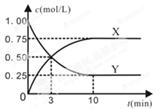
(1)Y的化学式是 。
(2)反应进行到3min时, v正 v逆(填“>”或“<”、“=”)。反应前3min,H2的平均反应速率v(H2)= mol·L-1·min-1。
(3)不能判断该反应达到化学平衡状态的依据是 。
| A.容器内各气体的体积比保持不变 | B.混合气体密度不变 |
| C.3v逆(CH3OH) =v正(H2) | D.H2转化率为75% |
 CO2(g) + 3H2(g)的平衡常数K= (计算结果保留2位小数)。
CO2(g) + 3H2(g)的平衡常数K= (计算结果保留2位小数)。 (1)CO2 (2)> 0.5 (3)B (4)向右 (5)0.19
解析试题分析:(1)由图像可知生成物X的浓度变化是0.75mol/L,反应物Y的浓度变化也是0.75mol/L。根据反应方程式可知CO2(g)+3H2(g) CH3OH (g)+H2O(g) △H=-49.0 kJ/mol,无论是哪种生成物,方程式的系数都是1,其改变量与反应物相同。则根据反应时各物质的关系可知只能是方程式中的系数为1的物质。因此Y的化学式是CO2。(2)反应进行到10min时得到化学平衡。所以在进行到3min时, v正> v逆,反应正向进行。反应前3min,V(CO2)=0.5mol/L÷3min=1/6mol/(L·min)。由于V(H2) =3V(CO2)=3×1/6mol/(L·min)= 0.5 mol/(L·min)。 (3)A.容器内各气体的体积比保持不变,则任何组分的物质的量不变,物质的量浓度不变,反应达到平衡。正确。B.由于反应是在一恒温、恒容密闭容器中进行。无论反应是否发生,也无论反应进行到哪种程度,由于容器的容积不变、物质的质量不变,所以混合气体密度不变。错误。C.在任何时刻都存在速率关系:3v正(CH3OH) =v正(H2),而3v逆(CH3OH) =v正(H2)。则v正(CH3OH)= v逆(CH3OH)。即用同一物质表示的反应速率V正=V逆。因此反应达到了平衡状态。正确。D.由图像可知:达到平衡状态时c(CO2)=0.25mol/L,改变了0.75mol/L.由于n(CO2):n(H2)=1:3,所以H2改变的浓度3×0.75mol/L,H2的起始浓度3mol/L.所以H2转化率为(3×0.75mol/L ÷3)×100%=75%。正确。因此不能判断该反应达到化学平衡状态的依据的选项是B。(4)上述反应达到平衡后,往容器中同时加入1molCO2和1mol H2O(g),由于增大了反应物的浓度,所以此时平衡将向右移动。(5)上述温度下,反应CH3OH (g) + H2O(g)
CH3OH (g)+H2O(g) △H=-49.0 kJ/mol,无论是哪种生成物,方程式的系数都是1,其改变量与反应物相同。则根据反应时各物质的关系可知只能是方程式中的系数为1的物质。因此Y的化学式是CO2。(2)反应进行到10min时得到化学平衡。所以在进行到3min时, v正> v逆,反应正向进行。反应前3min,V(CO2)=0.5mol/L÷3min=1/6mol/(L·min)。由于V(H2) =3V(CO2)=3×1/6mol/(L·min)= 0.5 mol/(L·min)。 (3)A.容器内各气体的体积比保持不变,则任何组分的物质的量不变,物质的量浓度不变,反应达到平衡。正确。B.由于反应是在一恒温、恒容密闭容器中进行。无论反应是否发生,也无论反应进行到哪种程度,由于容器的容积不变、物质的质量不变,所以混合气体密度不变。错误。C.在任何时刻都存在速率关系:3v正(CH3OH) =v正(H2),而3v逆(CH3OH) =v正(H2)。则v正(CH3OH)= v逆(CH3OH)。即用同一物质表示的反应速率V正=V逆。因此反应达到了平衡状态。正确。D.由图像可知:达到平衡状态时c(CO2)=0.25mol/L,改变了0.75mol/L.由于n(CO2):n(H2)=1:3,所以H2改变的浓度3×0.75mol/L,H2的起始浓度3mol/L.所以H2转化率为(3×0.75mol/L ÷3)×100%=75%。正确。因此不能判断该反应达到化学平衡状态的依据的选项是B。(4)上述反应达到平衡后,往容器中同时加入1molCO2和1mol H2O(g),由于增大了反应物的浓度,所以此时平衡将向右移动。(5)上述温度下,反应CH3OH (g) + H2O(g) CO2(g) + 3H2(g)的平衡常数
CO2(g) + 3H2(g)的平衡常数 .解得K=0.19。
.解得K=0.19。
考点:考查反应时各物质浓度的关系、反应方向和化学平衡状态的判断、化学反应速率与化学平衡常数的计算的知识。


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:填空题
某校化学研究性学习小组学习了化学反应与能量的内容后,对CaCO3与稀盐酸的反应进行了相关探究。他们在室温条件下,将CaCO3块状固体放入1L、1mol?L-1稀盐酸中,记录下了随反应时间的变化生成CO2气体的物质的量情况,绘制成如图曲线。假设溶液的体积变化忽略不计,请分析以下问题: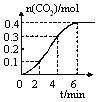
(1)若想加快该反应的速率,可以采取的措施是 、 (答两种)。
(2)0~2min内,用HCl浓度变化表示的平均反应速率为 ,比较0~2min、2~4min、4~6min三个时间段,反应速率最大的是 。
(3)根据定量的数据,定性的描述0~6min内该反应的化学反应速率的变化情况 ;呈现这种变化的原因是 。
(4)根据图像中曲线的变化趋势,第8min时,该反应的反应速率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
反应A(g)+B(g) C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。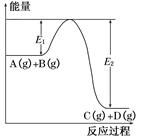
(1)该反应是________(填“吸热”或“放热”)反应。
(2)当反应达到平衡时,升高温度,A的转化率________(填“增大”“减小”或“不变”),原因是________________________________________
(3)反应体系中加入催化剂对反应热是否有影响?________,原因是__________________________________________
(4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1________,E2________。(填“增大”“减小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
向2 L密闭容器中通入6mol气体A和6mol气体B,在一定条件下发生反应:
xA(g)+yB(g)=pC(g)+qD(g) 已知:平均反应速率v(C)=1/2v(A);反应2 min时,A的浓度减少了1mol/L,B的物质的量减少了3mol,有6mol D生成。回答下列问题:
(1)反应2 min内,v(A)= ,v(B)= ;
(2)该反应化学方程式中x:y:p:q= ;
(3)如果其他条件不变,将容器的容积变为1 L,进行同样的实验,则与上述反应比较:反应速率 (填“增大”、“减小”或“不变”),理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
利用催化剂可使NO和CO发生反应:2NO(g)+2CO(g)??2CO2(g)+N2(g) ΔH<0。
已知增大催化剂的比表面积可提高化学反应速率。为了分别验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
| 实验 编号 | T(℃) | NO初始浓度 (mol·L-1) | CO初始浓度 (mol·L-1) | 催化剂的比表 面积(m2·g-1) |
| Ⅰ | 280 | 1.2×10-3 | 5.8×10-3 | 82 |
| Ⅱ | | 1.2×10-3 | | 124 |
| Ⅲ | 350 | | | 82 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
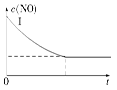
氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1价)和S(+6价)的速率v(纵坐标)与反应时间t(横坐标)的关系如图所示,已知该反应速率随着溶液中c(H+)的增大而加快。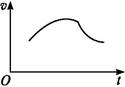
(1)反应开始时反应速率加快的原因是
(2)反应后期反应速率减慢的原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
500℃时,将H2和N2置于一容积为2 L的密闭容器中发生反应。反应过程中H2、N2和NH3物质的量变化如图所示,分析图像完成下列问题: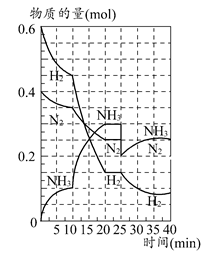
(1)0~10分钟,N2的平均反应速率为________mol·L-1·min-1,0~10分钟与10~20分钟两个时间段中,N2的反应速率之比为________。反应在第10 min可能改变的条件是________,运用图像信息说明该条件不是升温的原因:________。
(2)计算500℃时,反应N2+3H2 2NH3的平衡常数K的数值为________。保持温度不变,反应进行至25 min时,抽去0.1 mol氨,此时平衡常数K将________(填“增大”“减小”或“不变”)。保持体积不变,达到新平衡后的正反应的化学反应速率比原平衡状态________(填“大”“小”或“不变”)。
2NH3的平衡常数K的数值为________。保持温度不变,反应进行至25 min时,抽去0.1 mol氨,此时平衡常数K将________(填“增大”“减小”或“不变”)。保持体积不变,达到新平衡后的正反应的化学反应速率比原平衡状态________(填“大”“小”或“不变”)。
(3)在上图中画出25~40 min时间段内N2的物质的量的变化图像。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
一定温度下,在容积固定的V L密闭容器里加入n mol A、2n mol B,发生反应:A(g)+2B(g) 2C(g) ΔH<0,反应达平衡后测得平衡常数为K,此时A的转化率为x。
2C(g) ΔH<0,反应达平衡后测得平衡常数为K,此时A的转化率为x。
(1)K和x的关系满足K=________。在保证A浓度不变的情况下,增大容器的体积,平衡________(填字母)。
A.向正反应方向移动
B.向逆反应方向移动
C.不移动
(2)若该反应的逆反应速率与时间的关系如图所示: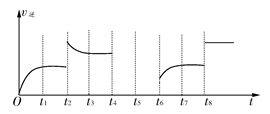
①可见反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的是什么条件:
t2时________________;
t8时________________;
②t2时平衡向________(填“正反应”或“逆反应”)方向移动;
③若t4时降压,t5时达到平衡,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系线。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上合成氨的反应:N2(g)+3H2(g)  2NH3(g)ΔH=-92.60 kJ·mol-1。
2NH3(g)ΔH=-92.60 kJ·mol-1。
(1)在绝热、容积固定的密闭容器中发生反应:N2(g)+3H2(g)  2NH3(g),下列说法能说明上述反应向正反应方向进行的是________(填序号)。
2NH3(g),下列说法能说明上述反应向正反应方向进行的是________(填序号)。
①单位时间内生成2n mol NH3的同时生成3n mol H2
②单位时间内生成6n mol N—H键的同时生成2n mol H—H键
③用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1∶3∶2
④混合气体的平均摩尔质量增大
⑤容器内的气体密度不变
(2)已知合成氨反应在某温度下2 L的密闭容器中进行,测得如下数据:
| 时间(h) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | | 1.00 | 1.00 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com