
【题目】某溶液中可能含有大量的Mg2+、Al3+、H+、Cl-,向该溶液中逐滴加入0.5 mol·L-1NaOH溶液,生成沉淀的质量和加入NaOH溶液的体积之间的关系如图所示,则可判断原溶液中

A.有Mg2+,没有Al3+
B.有Al3+,没有Mg2+
C.有Mg2+和Al3+
D.有大量的H+、Mg2+和Al3+
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一定条件下,在一恒容密闭容器中,能表示反应 X(g)+2Y(g)![]() 2Z(g) 一定达到化学平衡状态的是
2Z(g) 一定达到化学平衡状态的是
①容器中气体的密度不再发生变化
②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成2n mol Z,同时消耗2n mol Y
A. ①② B. ②③ C. ③④ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水四氯化锡(SnCl4)常用作有机合成的氯化催化剂。实验室可用熔融的锡与Cl2反应制备SnCl4。拟利用图中的仪器,设计组装一套实验装置制备SnCl4(每个装置最多使用一次)。
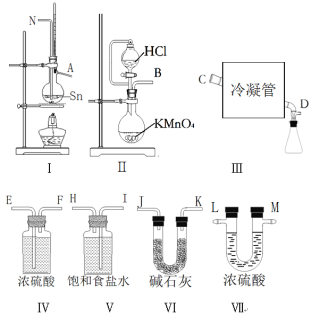
已知:①有关物理性质如下表
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ | |
Sn | 银白色固体 | 231.9 | 2260 | SnCl2易水解,SnCl4易水解生成固态二氧化锡, 锡与Cl2反应过程放出大量的热 |
SnCl4 | 无色液体 | -33 | 114 | |
SnCl2 | 无色晶体 | 246 | 652 |
②Fe3++Sn2+—Fe2++Sn4+ Fe2+ + Cr2O72- +H+—Fe3++Cr3++H2O(未配平)
回答下列问题:
(1)“冷凝管”的名称是________,装置Ⅱ中发生反应的离子方程式为________。
(2)用玻管(未画出)连接上述装置,正确的顺序是(填各接口的代码字母)_____。
(3)如何检验装置的气密性______,实验开始时的操作为_______。
(4)如果将制取的四氯化锡少许暴露于空气中,预期可看到的现象是出现白色烟雾,化学方程式为_______。
(5)可用重铬酸钾滴定法测定产品中的SnCl2的含量,准确称取该样品m g放于烧杯中,用少量浓盐酸溶解,加入过量的氯化铁溶液,再加水稀释,配制成250mL溶液,取25.00mL于锥形瓶中,用0.1000mol·L-1重铬酸钾标准溶液滴定至终点,消耗标准液15.00mL,则产品中SnCl2的含量为____%(用含m的代数式表示),在测定过程中,测定结果随时间延长逐渐变小的原因是____(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下图的说法不正确的是( )
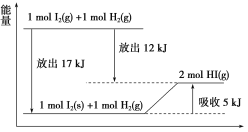
A.1 mol I2(s)与1 mol H2(g)化合生成2 mol HI(g)时,需要吸收5 kJ的能量
B.2 mol HI(g)分解生成1 mol I2(g)与1 mol H2(g)时,需要吸收12 kJ的能量
C.1 mol I2(s)变为1 mol I2(g)时需要吸收17 kJ的能量
D.I2(g)与H2(g)生成2HI(g)的反应是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在生产生活及科学研究方面应用非常广泛。回答下列问题:
(1)Fe原子的核外电子排布式为_________。
(2)含锰奥氏体钢是一种特殊的铁合金,主要由Fe和Mn组成,其中锰能增加钢铁的强度和硬度,提高耐冲击性能和耐磨性能。第三电离能I3(Fe)____I3(Mn)(填“大于”或“小于”),原因___。
(3)工业电解熔融的FeO、Fe2O3冶炼高纯铁。FeO与Fe2O3相比,_____熔点高,其主要原因是_______。
(4)FeCl3可与KSCN溶液发生显色反应。SCN-的三种元素中电负性最大的是_______。
(5)液态环戊二烯中存在的微粒间相互作用有____
A 范德华力 B 氢键 C ![]() 键 D π键
键 D π键
环戊二烯分子中碳原子的杂化轨道类型是_____
配合物中配体提供电子对的方式包括孤对电子、π电子等。二茂铁的分子结构如图所示,其中铁的配位数是____。

(6)Fe(CO)3与NH3在一定条件下可合成一种具有磁性的氮化铁。该磁性氮化铁的晶胞结构如图所示。六棱柱底边边长为acm,高为ccm,阿伏加德罗常数的值为NA,该磁性氮化铁的密度为____(列出计算式)g·cm-3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将图1所示装置中的盐桥(琼脂-饱和![]() 溶液)换成铜导线与石墨棒连接得到图2所示装置,发现电流计指针仍然有偏转。下列说法正确的是
溶液)换成铜导线与石墨棒连接得到图2所示装置,发现电流计指针仍然有偏转。下列说法正确的是

A. 图1中,铁棒质量减少5.6g,则甲池![]() 溶液的质量增加5.6g
溶液的质量增加5.6g
B. 图1中的石墨电极与图2中乙池石墨![]() 电极的电极反应式相同
电极的电极反应式相同
C. 两图所示装置的能量变化均是将化学能转化为电能
D. 图2中电子流向为![]() 电流计→石墨a→石墨b→铜丝→石墨c→
电流计→石墨a→石墨b→铜丝→石墨c→![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁烷在一定条件下裂解可按两种方式进行:
C4H10 ![]() C2H6 +C2H4,C4H10
C2H6 +C2H4,C4H10 ![]() CH4 +C3H6
CH4 +C3H6
如图是某化学兴趣小组进行丁烷裂解的实验流程。(注:![]() 能将烃氧化成
能将烃氧化成![]() 和
和![]() ,G后面装置与答题无关,省略)
,G后面装置与答题无关,省略)

按上图连好装置后,需进行的实验操作有:
①给D、G装置加热;②检查整套装置的气密性;③排出装置中的空气等
(1)这三步操作的先后顺序依次是______。
(2)氧化铝的作用是______,甲烷与氧化铜反应的化学方程式是______。
(3)B装置所起的作用是______。
(4)若对E装置中的混合物(溴水足量),再按以下流程实验:

①操作Ⅰ、操作Ⅱ分别是______、______。
②![]() 溶液的作用是(用离子方程式表示)__________________________。
溶液的作用是(用离子方程式表示)__________________________。
③已知B只有一种化学环境的氢原子,则B的结构简式为__________________、
(5)假定丁烷完全裂解,当(E+F)装置的总质量比反应前增加了1.82g,G装置的质量减少了4.16g,则丁烷的裂解产物中甲烷和乙烷的物质的量之比![]() ______(假定流经D、G装置中的气体能完全反应)
______(假定流经D、G装置中的气体能完全反应)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】与纯水的电离相似,液氨中也存在着微弱的电离:2NH3![]() NH4++NH2-据此判断以下叙述错误的是
NH4++NH2-据此判断以下叙述错误的是
A. 液氨中含有NH3、NH4、NH2-三种微粒
B. 一定温度下液氨中c(NH4+)·c(NH2-)是一个常数
C. 液氨的电离达到平衡c(NH3)= c(NH4+)=c(NH2-)
D. 只要不加入其他物质,液氨中c(NH4+)=c(NH2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自门捷列夫发现元素周期律以来,人类对自然的认识程度逐步加深,元素周期表中的成员数目不断增加。回答下列问题:
(1)2016年![]() 确认了四种新元素,其中一种为
确认了四种新元素,其中一种为![]() ,中文名为“
,中文名为“![]() ”。元素
”。元素![]() 可由反应:
可由反应:![]() +
+![]() =
=![]() +3
+3![]() 得到。该元素的质子数为______,
得到。该元素的质子数为______,![]() 与
与![]() 互为_________。
互为_________。
(2)![]() 位于元素周期表中第
位于元素周期表中第![]() 族,同族元素N的一种氢化物为NH2NH2,写出该化合物分子的电子式________________.该分子内存在的共价键类型有_______。
族,同族元素N的一种氢化物为NH2NH2,写出该化合物分子的电子式________________.该分子内存在的共价键类型有_______。
(3)该族中的另一元素P能呈现多种化合价,其中![]() 价氧化物的分子式为______,
价氧化物的分子式为______,![]() 价简单含氧酸的分子式为______。
价简单含氧酸的分子式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com