
【题目】下列反应的离子方程式正确的是( )
A. 往碳酸镁中滴加稀盐酸:CO![]() + 2H
+ 2H![]() = CO2↑+ H2O
= CO2↑+ H2O
B. 用小苏打治疗胃酸过多:HCO![]() + H
+ H![]() = CO2↑+ H2O
= CO2↑+ H2O
C. 盐酸滴入氨水中:H![]() + OH
+ OH![]() = H2O
= H2O
D. 锌溶解于稀硝酸中:Zn+ 2H![]() =Zn2++ H2↑
=Zn2++ H2↑
科目:高中化学 来源: 题型:
【题目】Ca(NO2)2常用作钢筋混凝土工程中的阻锈剂。硝酸工业尾气中含有大量氮氧化物,含较多NO的尾气可用于制取Ca(NO2)2,工业流程如下:
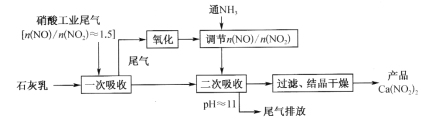
已知:Ca(OH)2 + NO + NO2![]() Ca(NO2)2 + H2O;
Ca(NO2)2 + H2O;
2Ca(OH)2 + 4NO2![]() Ca(NO2)2 + Ca(NO3)2 + 2H2O
Ca(NO2)2 + Ca(NO3)2 + 2H2O
回答下列问题:
(1)Ca(NO2)2的名称是____________。
(2)一次吸收后的尾气通过浓硝酸,一部分NO被浓硝酸氧化,反应的化学方程式是____;
在一定条件下,通入NH3将过多的NO2还原为N2以调节n(NO)/n(NO2)的比值,反应中氧化剂与还原剂的物质的量之比为___。
(3)在整个过程中,控制n(NO)/n(NO2)>1的目的是_______________。
(4)用石灰乳两次吸收的目的是_______。
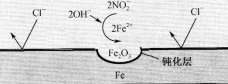
(5)在钢筋混凝土中,Ca(NO2)2可阻止Cl-对钢筋的腐蚀,其原理如下图示,该反应的离子方程式为____________。
(6)产品中主要含有的杂质是Ca(NO3)2。测定Ca(NO3)2含量的实验步骤是:称取0.410g产品溶于水,加入过量Na2SO4溶液,过滤,在滤液中加入足量NH4Cl饱和溶液(发生反应:NH4++NO2-![]() N2 + 2H2O);充分反应后,用稀硫酸酸化,向溶液中加入过量的15.00mL0.1000mol/L (NH4)2Fe(SO4)2溶液至充分反应(假设还原产物为NO);加入N-苯基邻氨基苯甲酸做指示剂,用0.1000mol/LK2Cr2O7标准溶液滴定剩余的Fe2+,消耗标准溶液2.00mL。则:产品中Ca(NO3)2的质量分数为________。
N2 + 2H2O);充分反应后,用稀硫酸酸化,向溶液中加入过量的15.00mL0.1000mol/L (NH4)2Fe(SO4)2溶液至充分反应(假设还原产物为NO);加入N-苯基邻氨基苯甲酸做指示剂,用0.1000mol/LK2Cr2O7标准溶液滴定剩余的Fe2+,消耗标准溶液2.00mL。则:产品中Ca(NO3)2的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、R、M均为短周期元素,X、Y同周期,X、Y两种元素最高价氧化物对应水化物化学式分别为H2XO4和HYO4。R、M同主族,R与冷水即可反应,M与热水反应缓慢。下列关系正确的是 ( )。
A. 原子半径X>Y B. 氢化物稳定性H2X>HY
C. 原子核内质子数R<M D. 溶液碱性R(OH)2<M(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温时,0.1 mol·L-1某一元酸HA在水中有0.1%发生电离,下列叙述错误的是
A. 该溶液的pH=4
B. 升高温度,溶液的pH增大
C. 此酸的电离常数约为1×10-7
D. 稀释HA溶液时,不是所有粒子浓度都一定会减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】严重的雾霾天气的形成与汽车尾气排放有关。汽车尾气中常含有CO、NOx等气体,为减轻污染,一般汽车都加装了“催化净化器”,可将汽车尾气中的有毒气体转化为无污染的气体。某化学兴趣小组在实验室模拟汽车尾气处理,设计了下图所示装置(部分夹持装置已略去)。
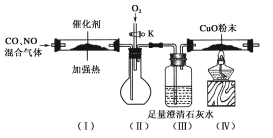
(1)装置(Ⅲ)的主要作用为________________________。
(2)停止加热,打开活塞K,放入适量氧气时,装置(Ⅱ)中可观察到的现象是___________________。
(3)该套装置中有不完善之处,还应在装置(Ⅳ)后补充____________。
(4)工业上常用纯碱液来吸收NOx,有关反应的化学方程式为2NO2+Na2CO3===NaNO2+NaNO3+CO2、NO2+NO+Na2CO3===2NaNO2+CO2。现有标准状况下a L NO2和b L NO的混合气体恰好被200 mL Na2CO3溶液完全吸收,则a、b应满足的关系为________。Na2CO3溶液的物质的量浓度为________mol·L-1(不必化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用下图装置用乙醇和浓硫酸反应制取乙烯,再用乙烯与溴的四氯化碳溶液反应制备1,2-二溴乙烷。

(1)在装置A中,生成的气体除乙烯外还有乙醚、CO2、SO2等,则生成乙烯的化学方程式为_______________,河沙的作用是________________。仪器a的名称为____________。
(2)装置B可起到安全瓶的作用,若气压过大,该装置中出现的现象为________。
(3)装置C可除去CO2、SO2,所盛放的溶液为________________________。
(4)装置D中进行的主要反应的化学方程式为____________;把试管置于盛有冰水的小烧杯中的目的是___________________________。
(5)装置E的作用是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、L、M五种元素的原子序数依次增大,X的阴离子与Y的内层电子数相等,Y原子的最外层电子数是次外层电子数的两倍,Z、L是空气中含量最多的两种元素,M是地壳中含量最高的金属元素。回答下列问题:
(1)X与L形成的常见阴离子的电子式为____________________。
(2)Z、X两元素按原子数目比1:3和2:4构成分子A和B,用电子式表示A的形成过程______,B的结构式_______________________。
(3)硒是人体必须的微量元素,与L同一主族,硒原子比L原子多两个电子层,则硒在周期表的位置为_______________,其最高价氧化物水化物的化学式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图的转化关系判断下列说法正确的是(反应条件已略去)
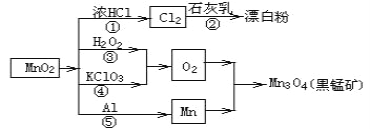
A. 反应①②③④⑤均属于氧化反应和离子反应
B. 反应⑤说明该条件下铝的还原性强于锰
C. 反应③中每生成 1mol O2 转移的电子数 4mol
D. 反应①中氧化剂与还原剂的物质的量之比为 1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锡是大名鼎鼎的"五金"—金、银、铜、铁、锡之一。四氯化锡可用作媒染剂,可利用如图所 示装置可以制备四氯化锡(部分夹持装置已略去);
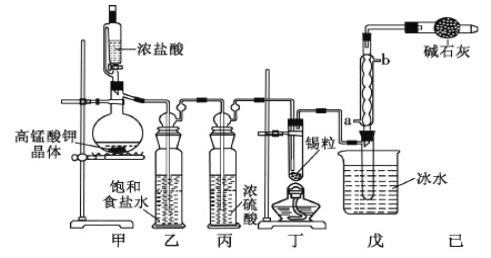
有关信息如下表:
化学式 | SnCl2 | SnCl4 |
熔点/℃ | 246 | -33 |
沸点/℃ | 652 | 144 |
其他性质 | 无色晶体,易被氧化 | 无色液体,易水解 |
回答下列问题:
(1)乙中饱和食盐水的作用为_____;戊装置中冷凝管的进水口为_________(填“a”或“b”)。
(2)用甲装置制氯气,MnO4 被还原为 Mn2+,该反应的离子方程式为_____________________________________
(3)将装置如图连接好,检查气密性,慢慢滴入浓盐酸,待观察到丁装置内充满黄绿色气体后,开始加 热丁装置,锡熔化后适当增大氯气流量,继续加热丁装置,此时继续加热丁装置的目的是:
① 促进氯气与锡反应;
② _____________。
(4)己装置的作用是_____________________。
(5)某同学认为丁装置中的反应可能产生 SnCl2 杂质,以下试剂中可用于检测是否产生 SnCl2 的有________(填标号)。
A.FeCl3 溶液(滴有 KSCN) B.溴水 C.AgNO3 溶液
(6)反应中用去锡粒 1.19g,反应后在戊装置的试管中收集到 2.38g SnCl4,则 SnCl4 的产率为________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com