
(5分)(1)在一密闭容器中充入1molNO2,建立如下平衡:2NO2  N2O4,测得NO2的转化率为a%,在其它条件不变的情况下,再充入1molNO2,待新平衡建立时,又测得NO2的转化率为b%。试问a、b值的大小关系为___ _。
N2O4,测得NO2的转化率为a%,在其它条件不变的情况下,再充入1molNO2,待新平衡建立时,又测得NO2的转化率为b%。试问a、b值的大小关系为___ _。
(2)汽车尾气中的主要污染物有CO、NOx,CO分析仪是以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。下列说法错误的是 。
| A.负极的电极反应式为:CO+O2—―2e-=CO2 |
| B.工作时电极b作正极,O2-由电极a流向电极b |
| C.工作时电子由电极a通过传感器流向电极b |
| D.传感器中通过的电流越大,说明汽车尾气中CO的含量越高 |
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:阅读理解
| 试管编号 | ① | ② | ③ | ④ | ⑤ |
| NaNO2含量/mg?L-1 | 0 | 20 | 40 | 60 | 80 |
| 实验方案 | 实验现象 | 实验结论 |
| 维生素C可以有效降低NaNO2的含量 |
查看答案和解析>>
科目:高中化学 来源:2014届黑龙江省高二下学期期末考试化学试卷(解析版) 题型:填空题
现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题.
A原子核外电子分占3个不同能级,且每个能级上排布的电子数相同
B元素原子的核外p电子总数比s电子总数少1
C原子p轨道上成对电子数等于未成对电子数,且与A同周期
D元素的族序数与周期数的差为4,且不与A元素在同一周期
E位于周期表中第七列
F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子
(1)A的基态原子最外层有 种不同运动状态的电子,F位于 区。
(2)E2+的基态核外电子排布式为 ,AD4为 (填极性或非极性)分子。
(3)A、B、C三种元素的电负性由小到大的顺序是 (用元素符号表示),B和C两元素中,B的第一电离能较大的原因是 ,与AC2互为等电子体的分子的名称为 。(只写一种)
(4)BD3 中心原子的杂化方式为 ,其分子空间构型为 。
(5)用晶体的x射线衍射法对F的测定得到以下结果:F的晶胞为面心立方最密堆积(如图),又知该晶体的密度为ρg/cm3,晶胞中该原子的配位数为 ;F的原子半径是 pm;(阿伏加德罗常数为NA)。

查看答案和解析>>
科目:高中化学 来源:重庆市万州二中2010-2011学年高三秋季开学测试(化学) 题型:填空题
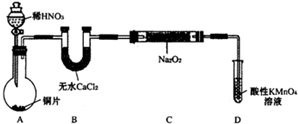
硫酸铜是一种应用极其广泛的化工原料.某课外兴趣小组将适量浓硝酸分多次加到铜粉与稀硫酸的混合物中,加热使之反应完全(装置如图I、图Ⅱ所示),通过蒸发、结晶得到硫酸铜晶体,并同时测定硫酸铜晶体中结晶水的含量.
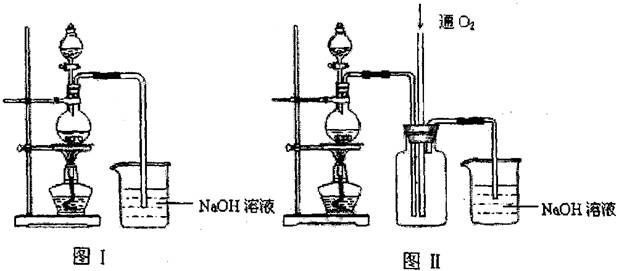
(1)怎样检查图I装置的气密性 。
(2)图I中分液漏斗内装的液体是 。
(3)图Ⅱ是图Ⅰ的改进装置,与图I相比,图Ⅱ装置的明显优点是 ,
, ,(可不答满).
(4)课外兴趣小组同学在测定胆矾(CuSO4·χH2O)晶体中结晶水的含量时.测得有关数据如下表:
|
加热前质量 |
加热后质量 |
|
|
m1(容器) |
m2(容器+晶体) |
m3(容器+无水CuSO4) |
|
5.4g |
7.9g |
6.8g |
①为完成测定,图Ⅲ中还缺少的仪器名称是 。
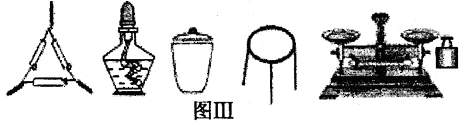
②判断样品已恒重的方法是 。
③测定所得胆矾(CuSO4·χH2O)中结晶水含量的实验中,称量操作至少进行 次。
④课外兴趣小组的测定结果x值(与CuSO4·5H2O相比) (填“偏高”、“偏低”、“不变”),可能的原因是 。(填字母序号)
a.加热温度过高
b.胆矾晶体的颗粒较大
c.加热后放在空气中冷却
d.胆矾晶体部分风化
|
学校 姓名 考号 班级
|
|
……………………………………………密………………………………………封……………………………………………….线………………………………………………….
|
查看答案和解析>>
科目:高中化学 来源: 题型:
现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题.
| A原子核外电子分占3个不同能级,且每个能级上排布的电子数相同 |
| B元素原子的核外p电子总数比s电子总数少1 |
| C原子p轨道上成对电子数等于未成对电子数,且与A同周期 |
| D元素的族序数与周期数的差为4,且不与A元素在同一周期 |
| E位于周期表中第七列 |
| F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子 |
(1)A的基态原子最外层有 种不同运动状态的电子,F位于 区。
(2)E2+的基态核外电子排布式为 ,AD4为 (填极性或非极性)分子。
(3)A、B、C三种元素的电负性由小到大的顺序是 (用元素符号表示),B和C两元素中,B的第一电离能较大的原因是 ,与AC2互为等电子体的分子的名称为 。(只写一种)
(4)BD3 中心原子的杂化方式为 ,其分子空间构型为 。
(5)用晶体的x射线衍射法对F的测定得到以下结果:F的晶胞为
面心立方最密堆积(如右图),又知该晶体的密度为ρg/cm3,
晶胞中该原子的配位数为 ;F的原子半径是 pm;
(阿伏加德罗常数为NA)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com