
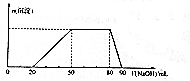
 ij50 mL��Һ�п��ܺ���H+��Na+��NH4+��Mg2+��Al3+��SO42-�����ӣ��������Һ�м���5 mol•L-1NaOH��Һʱ���������ɳ��������ʵ���n����������NaOH��Һ�����V��NaOH���仯��ϵ��ͼ��ʾ������˵����ȷ���ǣ�������
ij50 mL��Һ�п��ܺ���H+��Na+��NH4+��Mg2+��Al3+��SO42-�����ӣ��������Һ�м���5 mol•L-1NaOH��Һʱ���������ɳ��������ʵ���n����������NaOH��Һ�����V��NaOH���仯��ϵ��ͼ��ʾ������˵����ȷ���ǣ�������| A�� | ԭ��Һ��һ������Mg2+��Al3+��H+��SO42- | |
| B�� | ԭ��Һ��Al3+��Ũ��Ϊ1mol•L-1 | |
| C�� | ԭ��Һ��NH4+�����ʵ���Ϊ0.4mol | |
| D�� | �������NaOH����Һ�����Ϊ90mLʱ����Ӧ����Һ�е�����ֻ��Na+��SO42- |
���� ��ʼ����NaOHû�г����������������һ����H+�������г��������������ʧ����һ��û��Mg2+��һ����Al3+���м�γ������������䣬ӦΪNH4++OH-=NH3•H2O�ķ�Ӧ������NH4+�������ǵõ���������������ȫ���ܽ⣬�������ӷ�Ӧ���������������жϼ�����ػ�ѧ����ʽ���м��㣮
��� �⣺��ͼ���֪����ʼʱ����������˵������H+��H++OH-=H2O��������������NaOH��Һ�����Ϊ20mL��ͼ������һ��ƽ̨��˵������OH-ʱ�������ɣ���NH4+��NH4++OH-=NH3•H2O��笠�������������Ϊ30mL�������Һ��������˵����Һ�в���Mg2+������Al3+������Al3++3OH-=Al��OH��3��������������NaOH��Һ�����Ϊ30mL��������40mL����������ʱ������ʧ�����Կɵõ�H+��Al3+��NH4+�����ʵ���֮��Ϊ2��1��3�����ݵ�����ԭ����һ������SO42-��
A��ԭ��Һ��һ������NH4+��Al3+��H+��SO42-����Һ�в���Mg2+����A����
B������Al3++3OH-=Al��OH��3����ԭ��Һ��Al3+�����ʵ�����0.03L��5 mol•L-1��$\frac{1}{3}$=0.05mol��Ũ��Ϊ$\frac{0.05mol}{0.05L}$=1mol•L-1����B��ȷ��
C�����ݷ�Ӧ��NH4++OH-=NH3•H2O��ԭ��Һ��NH4+�����ʵ���Ϊ0.03L��5 mol•L-1=0.15mol����C����
D���������NaOH����Һ�����Ϊ90mLʱ����Ӧ����Һ�е�������Na+��SO42-��AlO2-����D����
��ѡB��
���� ���⿼�����ӵ��жϺͼ��㣬��Ŀ�Ѷ��еȣ�Ҫ��ѧ��������ʵ����ʲ����Ӧ�ã�ע��ͼ������������ķ�Ӧ�ǹؼ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ˮ�����γ�Al��OH��3���壬��������ˮ�� | |
| B�� | ���ʯ����Ȼ����Ӳ���������ʣ�������������������Ӧ | |
| C�� | Ư�ۡ����ᡢ��ƺ�Һ�ȶ����ڻ���� | |
| D�� | ��SO2ͨ��Ʒ����Һ����Һ��ɫ����Ȼָ�ԭɫ����SO2ͨ����ˮ����ˮ��ɫ�����Ҳ�ָܻ�ԭɫ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | [Cl-]��[NH4+]��[H+]��[OH-] | B�� | [NH4+]��[Cl-]��[OH-]��[H+] | C�� | [Cl-]��[NH4+]��[OH-]=[H+] | D�� | [Cl-]=[NH4+]��[H+]��[OH-] |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢� | B�� | �ڢ� | C�� | �ۢ� | D�� | �٢� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.1NA��NO��һ�ܱ�������������������ȫ��Ӧ���õ�0.1molNO2 | |
| B�� | һ�������µ��ܱ������У�6.4gSO2�ɱ����������õ�SO3�ķ�����Ϊ0.1NA | |
| C�� | ������18g����������Ũ������ת�Ƶ�����2NA | |
| D�� | 1L0.1mol/L FeCl3��Һ��ȫˮ��õ���Fe��OH��3��������С��0.1NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | HCl��NaOH��Ӧ���к��ȡ�H=-57.3 kJ•mol-1����H2SO4��Ca��OH��2��Ӧ���к��ȡ�H=2����-57.3��kJ•mol-1 | |
| B�� | CO��g����ȼ������283.0 kJ•mol-1����2CO2��g���T2CO��g��+O2��g���ġ�H=2����+283.0��kJ•mol-1 | |
| C�� | ��Ҫ���Ȳ��ܷ����ķ�Ӧһ�������ȷ�Ӧ | |
| D�� | 1 mol����ȼ��������̬ˮ�Ͷ�����̼���ų��������Ǽ����ȼ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ڢ�����������ֱ���FeCl2��Fe3+��Cl2 | |
| B�� | �������Ϸ�Ӧ�Ļ�ѧ����ʽ���Եõ�������ǿ����ϵΪCl2��Co2O3��Fe3+ | |
| C�� | �ڷ�Ӧ��������1 mol Cl2ʱ����2 mol HCl������ | |
| D�� | ���ݷ�Ӧ�٢�һ�����������õ�Cl2+FeBr2�TFeCl2+Br2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �¶� | v��H2C2O4�� | v��KMnO4�� | KMnO4��ɫʱ�� |
| 40�� | 10mL | 10mL | 40s |
| 40�� | 20mL | 20mL |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com