
| A.100℃时,pH=12的NaOH溶液和pH=2的H2SO4恰好中和,所得溶液的pH=7 |
| B.25℃时,0.2 mol/L Ba(OH)2溶液和0.2 mol/L HCl等体积混合,所得溶液的pH=7 |
| C.25℃时,0.2 mol/LNaOH溶液与0.2 mol/L CH3COOH恰好中和,所得溶液的pH=7 |
| D.25℃时,pH=12的氨水和pH=2的H2SO4等体积混合,所得溶液的pH>7 |
科目:高中化学 来源:不详 题型:单选题
A.H2O的电子式为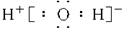 |
| B.4 ℃时,水的pH=7 |
| C.D216O中,质量数之和是质子数之和的两倍 |
| D.273 K、101 kPa,2.4L水所含分子数约为6.02×1023 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
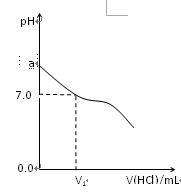
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CH4 ( g ) + 3/2O2 ( g ) = 2H2O ( l ) + CO ( g )△H1 |
| B.S ( s ) + 3/2O2 ( g ) = SO3 ( s )△H2 |
| C.C6H12O6 ( s ) + 6O2 ( g ) = 6CO2 (g) + 6H2O ( l )△H3 |
| D.CO ( g ) +1/2 O2 ( g ) = CO2 ( g )△H4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加水稀释10倍后,pH=4 |
| B.加水稀释后,溶液中c(H+)和c(OH-)均减少 |
| C.加入醋酸钠晶体后,溶液的pH增大 |
| D.加入等体积、pH=11的NaOH溶液后,c(Na+)= c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.某强碱性溶液中加入足量盐酸产生无色无味且能使澄清的石灰水变浑浊的气体,则该溶液中一定含有大量CO32- |
B.煮沸MgCO3悬浊液,得到M g(OH)2沉淀,说明MgCO3的溶解度小于Mg(OH)2 g(OH)2沉淀,说明MgCO3的溶解度小于Mg(OH)2的溶解度 |
| C.在铁器上电镀铜的实验过程中,电镀液(CuSO4溶液)的pH逐渐升高 |
D.欲制备F(OH)3胶体,向盛有沸水的 烧杯中滴加FeCl3饱和溶液并长时间煮沸 烧杯中滴加FeCl3饱和溶液并长时间煮沸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 y,则x值为
y,则x值为| A.2 | B.3 | C.4 | D.5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com