
| X | Y | ||
| Z | W | R |
| A. | 原子半径的大小顺序:Z>X>Y | |
| B. | W、Y的气态氢化物的稳定性:W>Y | |
| C. | Z单质一定是金属铝 | |
| D. | W、R的最高价氧化物对应水化物的酸性:W>R |
分析 A.同周期自左而右原子半径减小、同主族自上而下原子半径最大;
B.同主族自上而下元素的非金属性增强,元素的非金属性越强,其氢化物越稳定;
C.Z可能为Si元素;
D.同周期元素的非金属性随着原子序数的增大而增强,元素的非金属性越强,其最高价氧化物的水化物酸性越强.
解答 解:A.同周期自左而右原子半径减小、同主族自上而下原子半径最大,故原子半径:Z>X>Y,故A正确;
B.Y的非金属性大于W,所以Y、W的气态氢化物的稳定性:W<Y,故B错误;
C.Z可能为Si元素,故C错误;
D.非金属性R>W,故最高价氧化物对应水化物的酸性:R>W,故D错误,
故选A.
点评 本题考查元素周期律知识,难度不大,侧重对基础知识的巩固,理解掌握同周期、同主族元素性质的递变规律.


科目:高中化学 来源: 题型:解答题

 ,它的最高价氧化物对应水化物中含有的化学键有离子键、(极性)共价键,工业上冶炼D单质的化学方程式为2NaCl(熔融)$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑.
,它的最高价氧化物对应水化物中含有的化学键有离子键、(极性)共价键,工业上冶炼D单质的化学方程式为2NaCl(熔融)$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
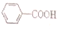 >H2CO3
>H2CO3 >HCO3-,现要将
>HCO3-,现要将 转变为
转变为 ,可行的方法是( )
,可行的方法是( )| A. | 与足量的NaOH溶液共热,再通入CO2 | |
| B. | 加稀硫酸共热后,再加入足量NaOH溶液 | |
| C. | 加热该物质溶液,再通入足量的SO2 | |
| D. | 与稀硫酸共热后,加入足量的Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油分馏出的各馏分均是纯净物 | |
| B. | 纤维素、淀粉、蛋白质和天然油脂都属于天然高分子化合物 | |
| C. | 煤可与水蒸气反应制成水煤气,水煤气的主要成分为CO和H2 | |
| D. | 1mol蔗糖在酸性条件下水解得到2mol葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同主族元素含氧酸的酸性随核电荷数的增加而减弱 | |
| B. | 核外电子排布相同的微粒化学性质也相同 | |
| C. | Cl?、S2?、Ca2+、K+半径逐渐减小 | |
| D. | 同周期主族非金属元素随原子序数递增,原子得电子能力增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 现有A、B、C、D、E、F六种物质或粒子,其中A、B、C、D都具有如图所示的结构或结构单元,(图中正四面体以外可能有的部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同).A、B的晶体类型相同.单质A的同素异形体能与B物质发生置换反应.C、D、E、F含有相等的电子数,且D是阳离子,D与F的组成元素相同.C、E、F的晶体类型相同,由E构成的物质常温下呈液态.
现有A、B、C、D、E、F六种物质或粒子,其中A、B、C、D都具有如图所示的结构或结构单元,(图中正四面体以外可能有的部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同).A、B的晶体类型相同.单质A的同素异形体能与B物质发生置换反应.C、D、E、F含有相等的电子数,且D是阳离子,D与F的组成元素相同.C、E、F的晶体类型相同,由E构成的物质常温下呈液态.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
. (任写一种).
(任写一种). )和CH2=CH2为原料制备
)和CH2=CH2为原料制备 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 往某固体中滴加稀盐酸有气泡产生--该固体一定是碳酸盐 | |
| B. | 往某溶液中滴加氯化钡溶液,产生不溶于稀硝酸的白色沉淀--该溶液一定含有硫酸根离子 | |
| C. | 生石灰块投入水中,水会沸腾--生石灰变成熟石灰的过程是放热反应 | |
| D. | 往品红溶液中通入某种气体,使品红褪色--该气体一定是二氧化硫 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com