
Ca2++C2O![]() ====CaC2O4↓ CaC2O4+H2SO4====CaSO4+H2C2O4
====CaC2O4↓ CaC2O4+H2SO4====CaSO4+H2C2O4
2KMnO4+5H2C2O4+3H2SO4====K2SO4+2MnSO4+10CO2↑+8H2O
现量取10.00 mL血样,用上述方法测定血钙含量时,耗用0.1200 mol·L-1 KMnO4溶液5.0 mL恰好达滴定终点,则此血样中的含钙量为( )
A.2.40 g·L-1 B.3.00 g·L-1
C.6.00 g·L-1 D.4.80 g·L-1
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
为测定人体血液中Ca2+的含量,有人设计如下方案:

若血样为10mL,消耗0.05mol?L-1 KMnO4(H+)溶液1.2mL,问:试写出有关反应方程式并计算出该血样中的含钙量(用g?L-1表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
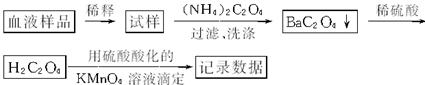
有关反应的化学方程式为:
2KMnO4+5H![]() K2SO4+2MnSO4+10CO2↑+8H2O,若血液样品为15 mL,滴定生成的草酸消耗0.001 mol·L-1的KMnO4溶液15.0 mL,则这种血液样品中的含钙量为
K2SO4+2MnSO4+10CO2↑+8H2O,若血液样品为15 mL,滴定生成的草酸消耗0.001 mol·L-1的KMnO4溶液15.0 mL,则这种血液样品中的含钙量为
C.0.000 3 mol·L-1 D.0.003 5 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2012-2013学年辽宁省大连二十四中高三(上)期中化学试卷(解析版) 题型:选择题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com