
【题目】下列元素中,占细胞鲜重最多的元素是
A. 碳 B. 氢 C. 氧 D. 氮
 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
【题目】下列有关物质性质的描述不符合事实的是
A.SO2可用作食品防腐剂B.金刚石是自然界中最硬的物质
C.亚硝酸盐可致癌,严禁用作防腐剂D.NO可用于某些疾病的治疗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,0.01mol·L-1的NaOH溶液中由水电离生成的H+浓度( )
A.0.01mol·L-1B.1×10-7mol·L-1C.1×10-12mol·L-1D.1×10-14mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应速率的说法正确的是
A. 用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率
B. 汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率减慢
C. SO2的催化氧化是一个放热的反应,所以升高温度,反应速率减慢
D. 100mL2mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废电池必须进行集中处理的问题被提到议事日程。其首要原因是( )
A.防止汞、镉和铅等重金属离子对土壤和水源的污染
B.为了利用电池外壳的金属材料
C.不使电池中渗泄的电解液腐蚀其他物品
D.回收其中的石墨电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图是铜与稀硝酸反应的两个实验装置图,请按要求回答问题:
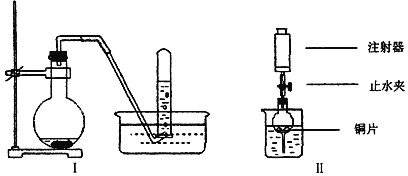
(1)铜与稀硝酸反应的离子方程式为_____________________________________________。
(2)I实验装置中能否证明铜与稀硝酸反应生成的是NO气体_______(选填“能”或“不能”), 简述理由_____________________________。
(3)若用Ⅱ实验装置进行实验,以证明铜与稀硝酸反应生成的气体是NO,则检查气密性的操作是______________________________________________________________________________。
(4)在Ⅱ实验装置的烧杯中加入一定体积的稀硝酸,打开止水夹,用注射器慢慢抽取干燥管内的空气,稀硝酸沿着干燥管慢慢上升,直到充满整个干燥管,停止抽拉注射器,关闭止水夹,此时观察干燥管内的现象是________________________________________;反应停止后,打开止水夹,用注射器抽取干燥管内的气体(事先已将注射器内原有的空气推出),关闭止水夹后取下注射器,并抽取一定量的空气,此时观察到的现象是____________________________________________。
(5)上述实验完成后,将注射器内的气体通入到NaOH溶液中,其目的是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合液中Al2(SO4)3与MgSO4的物质的量浓度之比为( ) 
A.6:1
B.1:1
C.2:1
D.1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、氨气催化氧化生产硝酸,硝酸厂常用催化还原法处理尾气:催化剂存在时用H2将NO2还原为N2。
已知:2 H2 ( g ) +O2 ( g )=2H2O ( g ) ΔH = -483.6 kJ/mol
N2 ( g ) +2O2 ( g )=2NO2 ( g ) ΔH = + 67.7 kJ/mol
则H2将NO2还原为N2的热化学反应方程式:___________________________
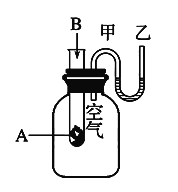
II、为了研究化学反应A+B===C+D的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升。试回答下列问题:
(1)该反应为_____(填“放热”或“吸热”)反应。ΔH___0(填>、<、=)
(2)A和B的总能量比C和D的总能量_____(填“高”或“低”)。
(3)物质中的______能通过化学反应转化成______能释放出来。
(4)反应物化学键断裂吸收的能量_____(填“高”或“低”)于生成物化学键形成放出的能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用Na2SO3固体与70%的硫酸反应制取SO2气体时,可用FeC13溶液吸收多余的SO2气体。
(1)写出SO2与FeC13溶液反应的离子方程式:_____________________________________。
(2)FeC13溶液吸收SO2气体一段时间后,吸收液中一定存在的离子有:H+、Fe2+、C1-、SO42-。某同
学认为还可能存在其他离子,并提出假设进行实验探究。
①提出合理假设:
假设1:还存在HSO3-、SO32-
假设2:还存在Fe3+
假设3:HSO3-、SO32-、Fe3+都不存在
②设计实验方案
实验步骤 | 现象和结论 |
步骤1:取少量吸收液于试管,滴加稀硫酸酸化,然后再滴入几滴___________溶液。 | 现象:_________ 结论:假设1不成立。 |
步骤2:__________ | 现象:________ 结论:假设2成立。 |
(3)测定空气中SO2含量的方法是:把500L含SO2气体的空气通入20mL含0.00015molKMnO4的溶液中,充分反应后,再用0.02000mol/L的KI溶液滴定过量的KMnO4,消耗KI 溶液25.00mL,则空气中的SO2含量为_________mg/L。(5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+,10I-+2MnO4-+16H+=2Mn2++5I2+8H2O)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com