
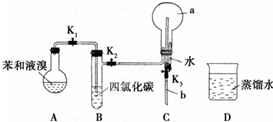
 ,烧瓶a中的实验现象是烧杯中的水沿玻璃管上升进入烧瓶,形成喷泉.
,烧瓶a中的实验现象是烧杯中的水沿玻璃管上升进入烧瓶,形成喷泉.分析 (1)苯与溴在溴化铁做催化剂的条件下发生取代反应,生成溴苯和溴化氢,溴化氢易溶于水;
(2)由于反应放热,苯和液溴均易挥发,溴的存在干扰检验H+和Br-,溴易溶于有机溶剂;
(3)根据粗苯中的成分及各试剂的作用分析,可溶性的物质易溶于水,溴和氢氧化钠能反应所以可用氢氧化钠除去溴;然后分液除去溴化钠和过量的氢氧化钠溶液,再用干燥剂吸收水分,最后利用物质沸点的不同可分离沸点不同的物质,据此分析.
解答 解:(1)苯与溴在溴化铁做催化剂的条件下生成溴苯和溴化氢,苯分子里的氢原子被溴原子所代替,
方程式为: ,该反应为取代反应,所以苯分子中不存在碳碳单双键交替,所以凯库勒观点错误,生成的溴化氢极易溶于水,所以C中产生“喷泉”现象,
,该反应为取代反应,所以苯分子中不存在碳碳单双键交替,所以凯库勒观点错误,生成的溴化氢极易溶于水,所以C中产生“喷泉”现象,
故答案为:取代反应; ;烧杯中的水沿玻璃管上升进入烧瓶,形成喷泉;
;烧杯中的水沿玻璃管上升进入烧瓶,形成喷泉;
(2)由于反应放热,苯和液溴均易挥发,苯和溴极易溶于四氯化碳,用四氯化碳除去溴化氢气体中的溴蒸气和苯,以防干扰检验H+和Br-,
故答案为:除去HBr气体中混有的Br2(g);
(3)粗溴苯中含有溴,提纯时,加入10%的NaOH溶液洗涤,可除去溴,然后分液除去溴化钠和过量的氢氧化钠溶液,再用干燥剂吸收水分,最后利用物质沸点的不同可分离沸点不同的物质,所以正确的操作顺序为②③④①,
故选:B.
点评 本题以实验为载体考查了有机物苯的性质,明确苯分子的结构特点及性质是解题关键,注意物质分离提纯时应明确混合物中的成分,然后根据各物质的性质采取相应的方法去除杂质,题目难度较大.


科目:高中化学 来源: 题型:填空题
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 1.43 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
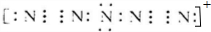 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验次数 | 初读数(mL) | 末读数(mL) |
| 1 | 0.20 | 21.40 |
| 2 | 0.00 | 21.00 |
| 3 | 1.60 | 26.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
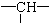 ,其余为氯原子.则氯原子的个数为( )
,其余为氯原子.则氯原子的个数为( )| A. | 2y+3x-x | B. | z+2-x | C. | 2y+z-x | D. | z+2y+2-x |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ②③ | C. | ④⑤ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2 H2O | B. | NH3 BCl3 | C. | PCl3 CH4 | D. | PCl5 CH4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com