
食盐是日常生活的必需品,也是重要的化工原料.粗食盐中常含有少量的Ca2+、Mg2+、SO42-等杂质离子.某校课外学习小组想利用给出的试剂对粗食盐进行提纯,然后将得到的纯净的氯化钠配制成一定物质的量浓度的氯化钠溶液.
提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、稀盐酸、75%乙醇、四氯化碳.
回答下列问题:
(1)欲除去粗食盐中的Ca2+、Mg2+、SO42-等离子,选用试剂的滴加顺序为________(只填化学式).
(2)用提纯后的NaCl固体配制500 mL 1.0 mol/L NaCl溶液.
仪器选择:
除容量瓶(规格:________)、托盘天平、药匙、量筒外,还需要的实验仪器是________.
实验步骤:
①计算;②________;③将②中的NaCl放入________中,用适量蒸馏水溶解;④转移溶液,并将洗涤液移入容量瓶;⑤定容,摇匀,贴标签.
误差分析:
①看到容量瓶的内壁有杂物,用蒸馏水洗净后直接使用,则所配溶液浓度________(填“偏高”、“偏低”或“无影响”,下同);
②为加速固体溶解,可稍微加热并不断搅拌.在溶液的温度未降至室温时,立即将其转移至容量瓶进行定容,则所配溶液浓度________;
③按规范的步骤逐一进行,加盖倒转摇匀后发现液面低于刻度线,未予理睬直接贴标签,则所配溶液浓度________.
|
答案:(1)BaCl2、NaOH、Na2CO3、HCl或NaOH、BaCl2、Na2CO3、HCl或BaCl2、Na2CO3、NaOH、HCl(合理即可) (2)500mL 烧杯、玻璃棒、胶头滴管 称量NaCl固体 烧杯 无影响 偏高 无影响 讲析:物质的分离与提纯又称离子除杂,一般是利用离子反应将某些离子转化为沉淀或气体除去.根据离子的特征反应,正确选择除杂试剂,要求不引入新的杂质离子,试剂要过量且过量的试剂必须除去.用多种试剂进行分离与提纯时,还应考虑加入试剂的先后顺序.配制一定物质的量浓度的溶液要按照正确的步骤进行,注意每步操作的目的以及使用的主要仪器,并会进行简单的误差分析. (1)先根据离子的特征反应,选择除杂试剂.除去SO42-,只能选择过量的BaCl2溶液,将SO42-转化为沉淀;若选用Ba(NO3)2溶液,会引入新的离子——NO3-,且NO3-不易除去.除去Mg2+,最好选择过量的NaOH溶液将其沉淀.除去Ca2+,只能选择过量的Na2CO3溶液,不能选择K2CO3溶液,否则会引入不易除去的K+.过量的Ba2+也需要用过量的Na2CO3溶液除去,过量的OH-、CO32-需要用过量的稀盐酸除去.这样加入试剂的先后顺序会有多种,确保SO42-在Ca2+之前已被除去即可. (2)根据配制溶液的体积,选用500 mL容量瓶,结合物质的量浓度,计算所需氯化钠固体的质量.利用托盘天平、药匙等仪器称量氯化钠固体,将称好的氯化钠固体在烧杯中溶解,然后用玻璃棒将其转移到容量瓶中,洗涤液也要转移到容量瓶中,最后用胶头滴管定容,摇匀后贴标签.对于误差,应根据c= 点评:本题考查了物质的提纯及一定物质的量浓度的溶液的配制方法,虽是“老生常谈”,但都是同学们必须掌握的基本实验操作.这类知识点的考查难度低.物质的分离、提纯还能结合离子方程式的书写进行考查,溶液的配制常与误差分析一起出现.明确原理、规范操作才能准确应用. |


 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:
(1)炸油条时1 kg面粉需加入0.5 kg水,4 g明矾和10 g小苏打及少量食盐等辅料,经烹炸,成品油条的产率一般为80%,通过计算说明若每天食用100 g油条,则摄入铝的量是__________________。?
(2)请列举我国国民在日常生活中摄入铝(除食品添加剂外)的三种可能途径。______________________________________________________________________?
查看答案和解析>>
科目:高中化学 来源:0115 月考题 题型:填空题
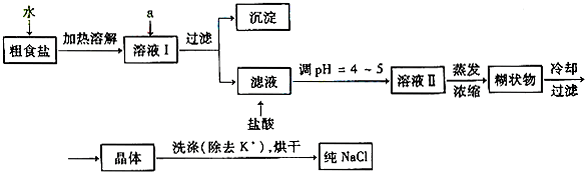
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com